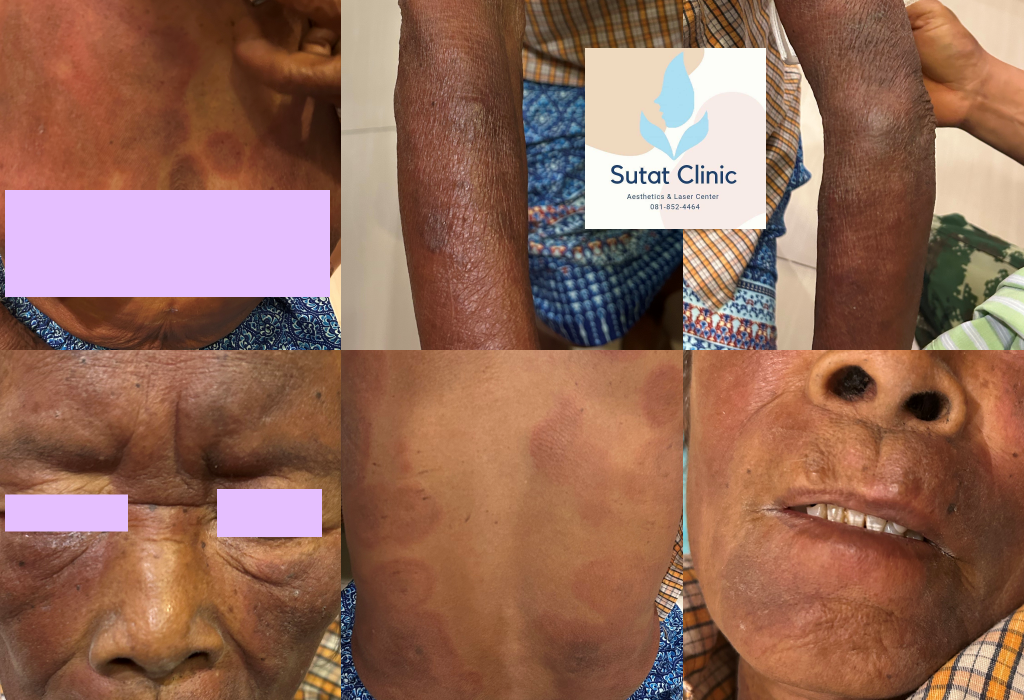
มะเร็งต่อมน้ำเหลืองชนิดทีเซลล์ที่ผิวหนัง
มะเร็งต่อมน้ำเหลืองชนิดทีเซลล์ที่ผิวหนัง (Cutaneous T Cell Lymphoma, CTCL)
คำว่า "มะเร็งต่อมน้ำเหลืองชนิดทีเซลล์ที่ผิวหนัง" (CTCL) ใช้เรียกกลุ่มของเนื้องอกที่มีความหลากหลาย ซึ่งเกิดจากทีเซลล์ที่มีความจำเพาะต่อผิวหนัง โดยแสดงความแตกต่างกันอย่างมากในแง่ของการแสดงออกทางคลินิก ลักษณะทางจุลพยาธิวิทยา รูปแบบของแอนติเจน (immunophenotype) และพยากรณ์โรค
CTCL คิดเป็นประมาณ 75–80% ของมะเร็งต่อมน้ำเหลืองที่มีต้นกำเนิดจากผิวหนังทั้งหมด ในขณะที่มะเร็งต่อมน้ำเหลืองชนิดบีเซลล์ที่ผิวหนัง (CBCL) คิดเป็นประมาณ 20–25%.
ในอดีต โรคที่รู้จักกันดีในกลุ่ม CTCL มีเพียง mycosis fungoides (MF) และ Sézary syndrome (SS) เท่านั้น อย่างไรก็ตาม ในช่วงสามทศวรรษที่ผ่านมา ได้มีการจำแนกชนิดใหม่ๆ ของ CTCL และ CBCL ขึ้น โดยอาศัยการผสมผสานข้อมูลทางคลินิก จุลพยาธิวิทยา และลักษณะทางภูมิคุ้มกัน พร้อมทั้งมีการจัดทำระบบการจำแนกประเภทใหม่สำหรับกลุ่มมะเร็งต่อมน้ำเหลืองที่มีต้นกำเนิดจากผิวหนัง
ข้อได้เปรียบสำคัญในการดูแลรักษามะเร็งต่อมน้ำเหลืองที่มีต้นกำเนิดจากผิวหนัง คือ สามารถสังเกตเห็นและทำการตัดชิ้นเนื้อเพื่อตรวจได้ง่าย ซึ่งมอบโอกาสพิเศษให้แก่แพทย์ผิวหนังในการเชื่อมโยงระหว่างลักษณะทางคลินิก พฤติกรรมของโรค ลักษณะทางจุลพยาธิวิทยา รูปแบบของแอนติเจน และลักษณะทางพันธุกรรมของโรคเหล่านี้
ดังนั้น แพทย์ผิวหนังจึงมีบทบาทสำคัญ ในการวินิจฉัย การจำแนกประเภท และการรักษาโรคเหล่านี้
ประวัติความเป็นมา
ในปี ค.ศ. 1806 แพทย์ชาวฝรั่งเศส ฌอง หลุยส์ อาลิเบิร์ต (Jean Louis Alibert) เป็นบุคคลแรกที่ได้บรรยายลักษณะของผู้ป่วยที่เป็นโรค mycosis fungoides (MF) โดยกรณีดังกล่าวได้ถูกบันทึกไว้ในหนังสือภาพทางการแพทย์ของเขาในชื่อว่า pian fungoïde แต่ต่อมาในปี ค.ศ. 1835 ได้มีการเปลี่ยนชื่อเป็น mycosis fungoïde เนื่องจากเนื้องอกผิวหนังบางชนิดมีลักษณะคล้ายเห็ด
ในปี ค.ศ. 1870 บาซิน (Bazin) ได้บรรยายถึงการดำเนินโรคจากระยะเริ่มต้นที่ไม่มีลักษณะจำเพาะ (premycotic phase) ไปสู่ระยะที่เกิดแผลนูน (plaque lesions) และสุดท้ายเป็นเนื้องอก ซึ่งถือเป็นหนึ่งในการบรรยาย "โมเดลการเกิดมะเร็งแบบหลายขั้นตอน" (multistep model) ครั้งแรกๆ
ในปี ค.ศ. 1885 วิดัล (Vidal) และ บร็อก (Brocq) ได้ใช้คำว่า "mycosis fungoides d’emblée" เพื่ออธิบายผู้ป่วยที่มีเนื้องอกผิวหนังตั้งแต่แรก โดยไม่ผ่านระยะที่เป็นปื้นหรือแผลนูนมาก่อน ซึ่งปัจจุบันทราบแล้วว่า กรณีเหล่านี้ส่วนใหญ่เป็น CTCL ประเภทอื่น
รูปแบบของ MF ที่มีลักษณะเป็น ผื่นแดงทั้งตัว (erythrodermic form) ถูกอธิบายในปี ค.ศ. 1892 โดย เบสเนียร์ (Besnier) และ ฮัลโลโป (Hallopeau)
หลังจากการบรรยายลักษณะทางคลินิกหลักของ MF แล้ว ก็มีการค้นพบโรคอื่นๆ เพิ่มเติม ได้แก่
- Sézary syndrome โดย เซซารี (Sézary) และ บูวเรน (Bouvrain) ในปี ค.ศ. 1938
- Pagetoid reticulosis โดย วอริงเงอร์ (Woringer) และ โคลอปป์ (Kolopp) ในปี ค.ศ. 1939
- Lymphomatoid papulosis (LyP) โดย แม็คออลเลย์ (Macaulay) ในปี ค.ศ. 1968
ดังนั้นในช่วงต้นทศวรรษ 1970 โรค MF และภาวะที่เกี่ยวข้องอีกบางชนิดจึงเป็นชนิดของมะเร็งต่อมน้ำเหลืองที่ผิวหนัง (cutaneous lymphoma) เพียงกลุ่มเดียวที่ได้รับการบรรยายอย่างค่อนข้างละเอียด
ขณะนั้น รายงานเกี่ยวกับมะเร็งต่อมน้ำเหลืองที่ผิวหนังชนิดอื่นที่ไม่ใช่ MF/SS มีอยู่น้อยมาก และในอดีต มักเรียกกลุ่มโรคเหล่านี้ว่า "malignant reticulosis" หรือ "reticulum cell sarcoma" และมีความเชื่อกันอย่างกว้างขวางว่า โรคเหล่านี้เป็นเพียงการแสดงออกที่ผิวหนังของมะเร็งต่อมน้ำเหลืองชนิดแพร่กระจายจากระบบภายใน และจึงถูกวินิจฉัยและรักษาในลักษณะนั้น
แนวคิดเรื่อง CTCL
ในปี ค.ศ. 1968 ลุทซ์เนอร์ (Lutzner) และ จอร์แดน (Jordan) ได้อธิบายลักษณะทางอัลตร้าสตรัคเจอร์ (ultrastructure) ของเซลล์ผิดปกติที่ไหลเวียนอยู่ในเลือดของผู้ป่วย Sézary syndrome (SS) โดยลักษณะเด่นของเซลล์เหล่านี้คือ นิวเคลียสมีรอยบุ๋มลึกและแคบ ทำให้ดูคล้ายกับสมอง (cerebriform appearance)
สามปีต่อมา เซลล์ลักษณะคล้ายกันนี้ก็ถูกพบใน ผิวหนัง และ ต่อมน้ำเหลือง ของผู้ป่วย mycosis fungoides (MF)
ต่อมาในปี ค.ศ. 1975 จากการสังเกตว่าเซลล์เนื้องอกใน MF, SS และโรคที่เกี่ยวข้องอื่นๆ นั้น ไม่เพียงแต่มีลักษณะทางสัณฐานวิทยาคล้ายคลึงกันเท่านั้น แต่ยังมี ลักษณะจำเพาะของทีเซลล์ (T cell phenotype) ร่วมกันอีกด้วย จึงได้มีการเสนอให้ใช้คำว่า "cutaneous T cell lymphoma (CTCL)" เพื่อเรียกกลุ่มโรคเหล่านี้
ภายในระยะเวลาไม่นาน แนวคิดเรื่อง CTCL นี้ก็ได้รับการยอมรับอย่างกว้างขวาง โดยเฉพาะอย่างยิ่งในสหรัฐอเมริกา
การแนะนำแนวคิด CTCL นี้ถือเป็น หมุดหมายสำคัญ ในประวัติศาสตร์ของกลุ่มโรคนี้ อย่างไรก็ตาม มีข้อเสียสำคัญตามมาคือ ในการศึกษาในเวลาต่อๆ มา หลายครั้งไม่ได้มีการแยกแยะ อย่างชัดเจนระหว่าง MF, SS และเนื้องอกทีเซลล์ชนิดอื่นๆ ซึ่งที่จริงแล้ว โรคเหล่านี้มีความแตกต่างกันอย่างมากในด้านการแสดงออกทางคลินิกและพฤติกรรมของโรค
แนวคิดเรื่องมะเร็งต่อมน้ำเหลืองที่มีต้นกำเนิดจากผิวหนัง (Primary Cutaneous Lymphomas)
ในช่วงเวลาเดียวกันกับที่มีการเสนอแนวคิดเรื่อง CTCL กลุ่มนักวิจัยหลายกลุ่มในยุโรปได้เริ่มจำแนกมะเร็งต่อมน้ำเหลืองที่ผิวหนัง โดยใช้เกณฑ์ของ Kiel classification ซึ่งเป็นระบบที่นักพยาธิวิทยาทางโลหิตวิทยาใช้สำหรับจัดกลุ่มมะเร็งต่อมน้ำเหลืองของต่อมน้ำเหลือง (nodal lymphomas)
ขณะนั้นพบว่า มะเร็งต่อมน้ำเหลืองชนิดบีเซลล์ (CBCL) และทีเซลล์ (CTCL) หลายชนิด (ที่ไม่ใช่เฉพาะ mycosis fungoides (MF) และ Sézary syndrome (SS)) สามารถแสดงอาการเฉพาะที่ผิวหนังได้ โดยไม่มีหลักฐานการแพร่กระจายไปนอกผิวหนัง ในขณะวินิจฉัย
นอกจากนี้ยังพบว่า primary cutaneous lymphomas เหล่านี้มักมีพฤติกรรมทางคลินิกและพยากรณ์โรคที่แตกต่างจากมะเร็งต่อมน้ำเหลืองที่มีลักษณะทางจุลพยาธิวิทยา (morphology) คล้ายกันซึ่งเกิดขึ้นในต่อมน้ำเหลือง และดังนั้นจึง จำเป็นต้องใช้แนวทางการรักษาที่แตกต่างกัน
นอกจากนี้ ยังพบความแตกต่างในหลายๆ ด้าน เช่น
- การมีหรือไม่มีของการถ่ายโอนโครโมโซมที่จำเพาะ (specific chromosomal translocations)
- การแสดงออกของยีนก่อมะเร็ง (oncogenes)
- การมีหรือไม่มีของลำดับพันธุกรรมหรือแอนติเจนของไวรัส (เช่น EBV)
- ความแตกต่างของตัวรับที่เกี่ยวข้องกับการเคลื่อนที่ของลิมโฟไซต์ไปยังเนื้อเยื่อ (tissue-related lymphocyte homing)
ความแตกต่างเหล่านี้ช่วยเน้นย้ำว่า primary cutaneous lymphomas เป็น กลุ่มโรคที่มีลักษณะเฉพาะของตัวเอง และช่วยอธิบายได้อย่างน้อยบางส่วนว่าทำไมพฤติกรรมทางคลินิกจึงแตกต่างกัน
ตัวอย่างเช่น มีการสังเกตว่า เซลล์มะเร็งชนิดทีเซลล์ใน CTCL ส่วนใหญ่จะมีการแสดงออกของ
- cutaneous lymphocyte antigen (CLA)
- ตัวรับเคมีคายน์ CC-chemokine receptors 4 (CCR4) และ 10 (CCR10)
ซึ่งแสดงให้เห็นว่าเซลล์มะเร็งเหล่านี้คือ คู่เหมือนของทีเซลล์ปกติที่มีหน้าที่มุ่งตรงสู่ผิวหนัง (skin-homing T cells) และนี่เป็นเหตุผลที่ว่า ทำไม CTCL จึงแสดงอาการที่ผิวหนัง
ประเด็นสำคัญที่สุด คือ พบว่า CTCL และ CBCL ชนิดต่างๆ ซึ่งมีพฤติกรรมทางคลินิกและความต้องการการรักษาที่แตกต่างกัน อาจมีลักษณะทางจุลพยาธิวิทยาที่เหมือนกัน ได้
ดังนั้นจึงสรุปได้ว่า การพิจารณาลักษณะทางจุลพยาธิวิทยาเพียงอย่างเดียว ไม่เพียงพอ จำเป็นต้อง ผสานข้อมูลทางคลินิกและข้อมูลแอนติเจน (immunophenotypic data) เข้าด้วยกันเพื่อให้ได้การวินิจฉัยที่ถูกต้อง (classification)
แนวทางการพิจารณาแบบบูรณาการนี้ นำไปสู่
- การแยกแยะชนิดใหม่หลายชนิดของ CTCL และ CBCL
- และกลายเป็นพื้นฐานของการจัดทำ ระบบจำแนกประเภทของ European Organization for Research and Treatment of Cancer (EORTC) สำหรับมะเร็งต่อมน้ำเหลืองที่มีต้นกำเนิดจากผิวหนัง
ระบบการจำแนกประเภทของ EORTC, WHO และ WHO-EORTC
ระบบจำแนกประเภทของ EORTC ถือเป็นระบบแรกที่ได้รับการออกแบบมาโดยเฉพาะสำหรับกลุ่มโรคมะเร็งต่อมน้ำเหลืองที่มีต้นกำเนิดจากผิวหนัง (primary cutaneous lymphomas) โดยมีการกำหนดประเภทของ CTCL และ CBCL ที่ชัดเจนและจำกัดจำนวน และมีการแบ่งแยกอย่างชัดเจนระหว่างมะเร็งต่อมน้ำเหลืองที่มีพฤติกรรมทางคลินิกแบบ
- ไม่รุนแรง (indolent)
- ระดับกลาง (intermediate)
- หรือรุนแรง (aggressive)
ด้วยการรวมเฉพาะโรคที่มีลักษณะจำแนกชัดเจนและสามารถจดจำได้ ระบบการจำแนกประเภทนี้จึงสามารถให้ข้อมูลรายละเอียดที่สำคัญแก่แพทย์เกี่ยวกับ
- การวางระยะของโรค (staging)
- แนวทางการรักษาที่เหมาะสม
- พฤติกรรมของโรคในทางคลินิก
- และการพยากรณ์โรค (prognosis)
ซึ่งทำให้ระบบนี้กลายเป็นแนวทางที่มีประโยชน์สำหรับการดูแลและการรักษาอย่างเหมาะสม
ความร่วมมือระหว่าง EORTC และองค์การอนามัยโลก (WHO) นำไปสู่การตีพิมพ์
WHO-EORTC consensus classification สำหรับมะเร็งต่อมน้ำเหลืองที่มีต้นกำเนิดจากผิวหนังในปี 2005 และ
การปรับปรุงครั้งล่าสุดในปี 2018
ในการปรับปรุงปี 2018 นี้:
คำศัพท์และคำจำกัดความของชนิดต่างๆ ของ CTCL ได้รับการทำให้เหมือนกับ การปรับปรุงปี 2016 ของ WHO classification
ใน WHO classification ฉบับปี 2023 (ซึ่งเป็น การปรับปรุงครั้งที่ 5) และใน International Consensus Classification (ICC) ปี 2022 ของเนื้องอกลิมฟอยด์ชนิดโตเต็มวัย (mature lymphoid neoplasms)
มีการเปลี่ยนแปลงเพียงเล็กน้อย ได้แก่:
โรค Primary cutaneous acral CD8-positive T cell lymphoma ถูกจัดให้เป็น ความผิดปกติของการเพิ่มจำนวนลิมโฟไซต์ (lymphoproliferative disorder) แทนที่จะจัดเป็นมะเร็งต่อมน้ำเหลือง
แนวทางปฏิบัติในการวินิจฉัย การจำแนกประเภท และการวางระยะของ CTCL
การวินิจฉัย (Diagnosis)
ขั้นตอนแรกของการประเมินผู้ป่วยที่สงสัยว่าอาจเป็น CTCL คือ ต้องตัดสินใจก่อนว่า เป็นมะเร็งต่อมน้ำเหลืองจริง หรือ เป็นภาวะผิวหนังที่ไม่ร้ายแรง (benign condition)
จำเป็นต้องทำการตัดชิ้นเนื้อผิวหนัง โดยควรใช้เทคนิคดังนี้:
- Deep punch biopsy ขนาด 4–6 มิลลิเมตร หรือ
- การผ่าตัดเอาชิ้นเนื้อออกทั้งก้อน (excisional biopsy) หรือเอาชิ้นเนื้อบางส่วน (incisional biopsy) จากรอยโรคที่มีลักษณะเด่นที่สุด
ในสหรัฐอเมริกา กรณีสงสัยระยะ patch หรือ plaque stage ของ MF (mycosis fungoides) อาจมีการใช้การตัดชิ้นเนื้อแบบ broad shave biopsy (ตัดแบบขนานพื้นผิว) ร่วมด้วย
การให้การรักษาด้วย
- ยาสเตียรอยด์เฉพาะที่ หรือ
- การฉายแสงรักษา (narrowband UVB, PUVA)
ล่วงหน้าอาจส่งผลให้ลักษณะทางจุลพยาธิวิทยา (histology) เปลี่ยนแปลงไปอย่างมาก
ดังนั้น ควรตัดชิ้นเนื้อจากรอยโรคที่ยังไม่ได้รับการรักษา เพื่อให้ผลวินิจฉัยแม่นยำที่สุด
อย่างไรก็ตาม แม้ได้ตัวอย่างชิ้นเนื้อที่เพียงพอแล้ว ก็ อาจยังไม่สามารถวินิจฉัยได้อย่างแน่นอน ด้วยเหตุผลสำคัญ 2 ประการ:
1. ลักษณะของโรคในระยะเริ่มต้น
- ใน CTCL หลายชนิด เช่น MF
ผู้ป่วยมักมีรอยโรคที่ผิวหนังมาก่อนเป็นเวลาหลายปี
ซึ่งในระยะนี้ทั้งการตรวจทางคลินิกและการตรวจชิ้นเนื้อ ยังไม่สามารถสรุปการวินิจฉัยได้ - การเปลี่ยนแปลงอย่างช้าๆ จากระยะก่อนวินิจฉัย (prediagnostic phase) ไปสู่ระยะที่เป็นมะเร็งชัดเจน (overt lymphoma)
อธิบายได้ว่าทำไมจึง ยากมาก ที่จะได้ข้อตกลงร่วมกันเรื่อง เกณฑ์ทางจุลพยาธิวิทยาขั้นต่ำ สำหรับการวินิจฉัย MF อย่างแน่นอน
ในผู้ป่วยหลายราย การทำ biopsy ซ้ำในเวลาที่เหมาะสม จะช่วยให้ได้การวินิจฉัยที่ถูกต้องในที่สุด
2. การพบการแทรกซึมของทีเซลล์ผิดปกติในภาวะอื่นๆ
- การแทรกซึมของ T cell ที่ผิดปกติ ไม่ได้พบแค่ใน CTCL เท่านั้น
แต่ยังพบได้ในภาวะตอบสนองแบบ reactive อื่นๆ เช่น - Lymphomatoid drug eruptions (ภาวะ T cell pseudolymphomas จากยา)
ดังนั้น การวินิจฉัยขั้นสุดท้ายควร:
- อาศัยการผสมผสานข้อมูลจาก ลักษณะทางคลินิก
- ผลการตรวจทางจุลพยาธิวิทยา
- และในหลายกรณีควรรวมถึง ข้อมูลจากการตรวจแอนติเจนของเซลล์ (immunophenotyping)
- ทั้งนี้ อาจเสริมด้วยผลการวิเคราะห์ การเรียงตัวของยีน (gene rearrangement analysis) เพื่อยืนยันความผิดปกติของทีเซลล์
การตรวจลักษณะทางภูมิคุ้มกัน (Immunophenotyping)
การศึกษาทางภูมิคุ้มกันวิทยาด้วยวิธี immunohistochemistry บนชิ้นเนื้อที่ฝังพาราฟิน
โดยใช้แอนติบอดีที่จับกับโมเลกุลบนพื้นผิวเซลล์หรือต่างๆ ในไซโตพลาสซึม
มี ความสำคัญอย่างยิ่ง ในการวินิจฉัยและการจำแนกประเภทของมะเร็งต่อมน้ำเหลืองที่ผิวหนัง
โดยการใช้ชุดแอนติบอดีเหล่านี้ สามารถช่วยแยกแยะได้ว่า:
- เนื้องอกนั้นมีต้นกำเนิดจาก T cell, B cell, NK cell, หรือ myeloid/monocytic
ได้อย่างแม่นยำ
สำหรับกลุ่ม CTCL การตรวจ immunophenotype เหล่านี้มีบทบาทสำคัญในการ
- แยกชนิดย่อยใหม่ๆ ของ CTCL
- และให้เกณฑ์สำคัญสำหรับการวินิจฉัยและการประเมินพยากรณ์โรค
ในแง่ของการวินิจฉัย CTCL
การแสดงให้เห็นถึง ลักษณะผิดปกติของเซลล์ (aberrant phenotype)
เช่น การที่ทีเซลล์เนื้องอกสูญเสียการแสดงออกของแอนติเจนที่เกี่ยวข้องกับทีเซลล์ เช่น
- CD2
- CD3
- CD4
- หรือ CD5
สามารถถือเป็น เกณฑ์เสริมที่สำคัญ ในการวินิจฉัย CTCL อย่างแน่นอนได้
อย่างไรก็ตาม
- การสูญเสียการแสดงออกของ CD7 ซึ่งอาจเกิดจากการกระตุ้นทีเซลล์แบบเรื้อรัง และพบได้บ่อยในโรคผิวหนังที่ไม่ร้ายแรง (benign dermatoses)
ถือเป็นตัวบ่งชี้ที่ไม่ค่อยน่าเชื่อถือเท่าไร
การวิเคราะห์การเรียงตัวของยีนตัวรับทีเซลล์ (T Cell Receptor Gene Rearrangement Analysis)
การวิเคราะห์การเรียงตัวของยีน T cell receptor (TCR) โดยใช้วิธีมาตรฐาน (เช่น ชุดตรวจ BIOMED-2)
สามารถให้ข้อมูลที่เป็นประโยชน์ในการวินิจฉัยและการวางระยะของ มะเร็งต่อมน้ำเหลืองชนิดร้าย (malignant lymphomas) ได้
อย่างไรก็ตาม จำเป็นต้อง ใช้ความระมัดระวัง ในการแปลผลการตรวจประเภทนี้ เพราะว่า:
- การพบกลุ่มทีเซลล์ที่มีต้นกำเนิดเดียวกัน (clonal T cell populations)
ไม่ได้เกิดขึ้นเฉพาะในรอยโรคที่เป็น CTCL เท่านั้น
แต่ยังพบได้ใน: - รอยโรคผิวหนัง
- ต่อมน้ำเหลือง
- และเลือดส่วนปลายของผู้ป่วย CTCL
- รวมถึงในกรณี ผิวหนังอักเสบเรื้อรัง ที่มาก่อนการเกิด MF ("clonal dermatitis")
- และในภาวะที่ดูเหมือนไม่ร้ายแรง เช่น
- pityriasis lichenoides et varioliformis acuta
- lichen planus
- lichen sclerosus
- และ pseudolymphomas บางชนิด
ดังนั้น การแสดงให้เห็นว่ามี clonal T cell population
ไม่สามารถใช้เป็นเกณฑ์ยืนยันการเป็นมะเร็งอย่างเด็ดขาดได้
จำเป็นต้อง พิจารณาร่วมกับลักษณะทางคลินิกและทางจุลพยาธิวิทยา ซึ่งยังคงเป็น “มาตรฐานทองคำ” (gold standard) สำหรับการวินิจฉัย
หาก:
- ผลทางคลินิก
- และผลทางจุลพยาธิวิทยา ไม่สอดคล้องกัน
- และ ไม่พบลักษณะภูมิคุ้มกันผิดปกติ (aberrant phenotype)
ไม่ควรทำการวินิจฉัย CTCL อย่างแน่นอน
เทคนิคใหม่: การหาลำดับยีนความแม่นยำสูง (High-throughput sequencing: HTS)
HTS ของยีน TCR โดยเฉพาะ TCRβ gene ได้ถูกพัฒนาเป็นเทคนิคใหม่
- สามารถให้ข้อมูลเชิงลึกเกี่ยวกับ จำนวน clone ของ T cell ที่มีอยู่ในตัวอย่าง
- รวมถึง สัดส่วน (relative frequency) ของแต่ละ clone
HTS-TCR เป็นเทคนิคที่
- มีความไวสูงกว่าวิธีเดิมมาก
- เหมาะสำหรับการวินิจฉัย CTCL ในระยะเริ่มต้น
- และสามารถใช้ติดตาม clone ของ T cell เฉพาะตัวในระยะเวลาต่อเนื่อง และหลังการรักษา
นอกจากนี้
HTS-TCR สามารถทำได้ในตัวอย่างจากหลายแหล่งพร้อมกัน เช่น
- ผิวหนัง
- และเลือดส่วนปลาย
ข้อมูลวิจัยล่าสุด แสดงว่า:
- หากพบ tumor clone frequency >25% ในรอยโรคผิวหนังของผู้ป่วย MF ระยะเริ่มต้น
จะสัมพันธ์กับ การมีอัตราการรอดชีวิตลดลง
การจำแนกประเภท (Classification)
เมื่อสามารถ วินิจฉัยโรค CTCL ได้แล้ว ขั้นตอนต่อไปคือต้อง ระบุชนิดของ CTCL ให้แน่นอน
อย่างที่ได้กล่าวไปก่อนหน้านี้ว่า
- การวินิจฉัยทางจุลพยาธิวิทยา (histologic diagnosis) ไม่ใช่การวินิจฉัยขั้นสุดท้าย
- หมายความว่า CTCL ไม่สามารถจำแนกได้โดยอาศัยเพียงข้อมูลทางจุลพยาธิวิทยาเท่านั้น
ตัวอย่างเช่น:
กรณีที่ตัดชิ้นเนื้อผิวหนังแล้วพบว่า:
- มีการแทรกซึมของทีเซลล์ขนาดใหญ่ที่ผิดปกติ (large anaplastic หรือ pleomorphic T cells) ในชั้นหนังแท้ (dermis)
- และเซลล์เหล่านี้มีการแสดงออกของ CD30-positive
การวินิจฉัยทางจุลพยาธิวิทยาในกรณีนี้จะเป็น:
- anaplastic large cell lymphoma (ALCL) ที่แสดง CD30-positive
แต่ในความเป็นจริงแล้ว การวินิจฉัยขั้นสุดท้าย ยังขึ้นอยู่กับภาพทางคลินิกด้วย ซึ่งอาจเป็นไปได้หลายอย่าง เช่น
- Primary cutaneous ALCL (มะเร็ง ALCL ที่เกิดเฉพาะที่ผิวหนัง)
- Cutaneous involvement of systemic ALCL (มะเร็ง ALCL จากระบบภายในที่กระจายมาที่ผิวหนัง)
- Large cell transformation ของ MF ที่มีการแสดง CD30
- หรือ Lymphomatoid papulosis (LyP) (ในกรณีที่เป็นตุ่มผื่นเล็กๆ ที่หายได้เองซ้ำๆ)
แน่นอนว่า แต่ละกรณี มีแนวทางการวางระยะโรค (staging) และ แนวทางการรักษา ที่ แตกต่างกันอย่างสิ้นเชิง
ใน ตารางที่ 1 มีการสรุปการวินิจฉัยแยกโรค (differential diagnosis) สำหรับ 4 กลุ่มลักษณะทางจุลพยาธิวิทยา ได้แก่:
- CTCL ที่มีลักษณะ epidermotropic (แทรกซึมเข้าสู่หนังกำพร้า)
- CTCL ที่มีการแทรกซึมของเซลล์ผิดรูปแบบกระจาย (diffuse pleomorphic infiltrates)
- CTCL ที่แสดง CD30-positive
- และ subcutaneous CTCL (ที่มีการแทรกซึมในชั้นไขมันใต้ผิวหนัง)
การแบ่งกลุ่มนี้:
- ไม่ได้ครบถ้วนสมบูรณ์
- และ ไม่ได้ตั้งใจให้ใช้เป็นระบบจำแนกประเภทแทนระบบหลัก
จุดประสงค์มีเพียงเพื่อ:
- แสดงให้เห็นตัวอย่าง ว่า
การวินิจฉัยขั้นสุดท้าย จำเป็นต้องผสานข้อมูลทางจุลพยาธิวิทยา ร่วมกับ
ข้อมูลทางคลินิก และ
ข้อมูลทางภูมิคุ้มกันวิทยา (immunophenotypic data)
เพื่อให้ได้การวินิจฉัยที่ถูกต้อง
ตารางที่ 1
การวินิจฉัยแยกโรคของรูปแบบจุลพยาธิวิทยาที่พบบ่อยใน Cutaneous T Cell Lymphoma (CTCL)
|
หมวดหมู่ทางจุลพยาธิวิทยา |
การวินิจฉัยแยกโรค |
เกณฑ์หรือเบาะแสการวินิจฉัย |
|
Epidermotropic CTCL (เลียนแบบหรือสอดคล้องกับระยะ plaque ของ MF) |
Mycosis fungoides (MF) |
- ลักษณะเด่นเป็นปื้นและคราบ (patches and plaques) |
|
Pagetoid reticulosis |
- ปื้นเดี่ยว มักพบที่ปลายแขนขา |
|
|
Lymphomatoid papulosis (LyP), type B หรือ D |
- มีตุ่มผื่น (papules) ที่หายเองซ้ำๆ |
|
|
Primary cutaneous aggressive epidermotropic CD8-positive cytotoxic T cell lymphoma |
- มี plaque infiltration แต่ก็มักมีตุ่มหรือเนื้องอกที่แตกได้ (ulceration) |
|
|
Sézary syndrome |
- มักมีการแทรกซึมที่ค่อนข้างเหมือนกันทางจุลพยาธิวิทยา |
|
|
Adult T cell leukemia/lymphoma |
- อาจมีลักษณะทางคลินิกและจุลพยาธิวิทยาคล้าย MF |
|
หมวดหมู่ทางจุลพยาธิวิทยา |
การวินิจฉัยแยกโรค |
เกณฑ์หรือเบาะแสการวินิจฉัย |
|
CTCL with diffuse pleomorphic infiltrates (CD30−) (เลียนแบบหรือสอดคล้องกับระยะ tumor ของ MF; อาจมีเซลล์ CD30+ บ้าง) |
Tumor stage MF |
- พบ patch และ plaque ร่วมกัน |
|
Primary cutaneous peripheral T cell lymphoma, NOS |
- ทางจุลพยาธิวิทยาอาจแยกจาก MF ระยะ large cell transformation ได้ยาก |
|
|
Primary cutaneous CD4-positive small/medium T cell lymphoproliferative disorder หรือ nodular pseudo-T cell lymphoma |
- มีแค่ plaque หรือ tumor เดี่ยว (2–3 ซม.) |
|
หมวดหมู่ทางจุลพยาธิวิทยา |
การวินิจฉัยแยกโรค |
เกณฑ์หรือเบาะแสการวินิจฉัย |
|
CD30-positive CTCL |
Lymphomatoid papulosis, type A/C |
- ผื่นตุ่มหรือก้อนที่หายเองซ้ำๆ |
|
Primary cutaneous anaplastic large cell lymphoma (C-ALCL) |
- มักเป็นตุ่มหรือก้อนเดี่ยวหรือจำกัดพื้นที่ |
|
|
Systemic ALCL with secondary skin involvement |
- มีการแพร่กระจายจากระบบภายใน (ยกเว้นในกรณีที่เกี่ยวข้องกับต่อมน้ำเหลืองแค่ 1 กลุ่มที่ใกล้เคียงซึ่งมีพยากรณ์ดีเหมือน C-ALCL) |
|
|
MF with large cell transformation |
- ผสมระหว่างเซลล์ cerebriform แบบปกติกับเซลล์ขนาดใหญ่ |
|
หมวดหมู่ทางจุลพยาธิวิทยา |
การวินิจฉัยแยกโรค |
เกณฑ์หรือเบาะแสการวินิจฉัย |
|
CTCL with subcutaneous involvement |
Subcutaneous panniculitis-like T cell lymphoma |
- การแทรกซึมจำกัดอยู่ที่ชั้นไขมันใต้ผิวหนัง (subcutis) |
|
Other types of CTCL |
- การแทรกซึมใต้ผิวหนังอาจเกิดจากการขยายตัวของการแทรกซึมในชั้นหนังแท้ |
ตัวย่อ:
- ALK = Anaplastic Lymphoma Kinase
- βF1 = ตัวบ่งชี้การมีต้นกำเนิดจาก T cell ชนิด α/β
- CLA = Cutaneous Lymphocyte Antigen
- C-ALCL = Cutaneous Anaplastic Large Cell Lymphoma
- EMA = Epithelial Membrane Antigen
- PD-1 = Programmed Death-1 (CD279)
- TIA = T Cell Restricted Intracellular Antigen
· แนวทางปฏิบัติ (Practical Guidelines)
· สำหรับแพทย์หรือบุคลากรที่ไม่ได้เกี่ยวข้องกับการวินิจฉัยและจำแนกประเภท CTCL เป็นประจำ และอาจรู้สึกสับสนกับชนิดต่างๆ ที่มีจำนวนมาก การใช้วิธีแบบ เป็นขั้นตอน (stepwise approach) อาจช่วยเป็นแนวทางปฏิบัติที่ชัดเจนได้
ขั้นตอนที่หนึ่ง
- โดยอาศัยการผสมผสานข้อมูลจาก คลินิก, จุลพยาธิวิทยา และ ภูมิคุ้มกันวิทยา (immunophenotyping)
- ให้ทำการแยกกลุ่มระหว่าง:
- กลุ่ม mycosis fungoides (MF) แบบคลาสสิก
- MF variants (ชนิดย่อยของ MF)
- และ Sézary syndrome (SS)
- แยกออกจาก CTCL ชนิดอื่นๆ
เหตุผล ของการทำขั้นตอนนี้คือ:
- แพทย์ผิวหนังส่วนใหญ่ คุ้นเคย กับกลุ่มโรค MF และ SS มากกว่า
- โรคในกลุ่มนี้คิดเป็นประมาณ 65% ของ CTCL ทั้งหมด
- และโรคกลุ่มนี้จำเป็นต้องมี แนวทางการวางระยะ (staging) และ การรักษา (therapy) ที่แตกต่างจาก CTCL รูปแบบอื่นๆ
ขั้นตอนที่สอง
- พิจารณากลุ่มที่สอง คือกลุ่ม primary cutaneous CD30-positive lymphoproliferative disorders
ความหมายคือ:
- เมื่อประเมินชิ้นเนื้อผิวหนังจากผู้ป่วยที่สงสัยว่าเป็น CTCL
ควรทำการย้อม CD30 immunostaining เสมอ
กลุ่มนี้รวมถึง:
- Cutaneous ALCL (C-ALCL)
- และ Lymphomatoid papulosis (LyP)
ซึ่งสองโรคนี้รวมกันคิดเป็น กลุ่มที่พบได้บ่อยเป็นอันดับสอง ของ CTCL
ผู้ป่วยในกลุ่มนี้:
- โดยทั่วไปมี พยากรณ์โรคที่ดีมาก
- และส่วนใหญ่สามารถดูแลโดยแพทย์ผิวหนังได้โดยไม่ยาก
ขั้นตอนที่สาม
- เมื่อผ่านสองขั้นตอนแรก จะสามารถจำแนก CTCL ได้ถูกต้องประมาณ 90% แล้ว
- กลุ่มที่เหลืออยู่ (ประมาณ 10%) คือ ชนิดที่พบได้น้อย ซึ่งรวมถึงทั้งชนิดที่พฤติกรรมไม่รุนแรงและชนิดที่พฤติกรรมรุนแรง ได้แก่:
กลุ่มที่มีพฤติกรรมไม่รุนแรง (indolent clinical behavior)
- Subcutaneous panniculitis-like T cell lymphoma
- Primary cutaneous CD4-positive small/medium T cell lymphoproliferative disorder
- Primary cutaneous acral CD8-positive T cell lymphoproliferative disorder
กลุ่มที่มีพฤติกรรมรุนแรง (aggressive clinical behavior)
- Extranodal NK/T cell lymphoma, nasal type
- Primary cutaneous gamma/delta T cell lymphoma
- Primary cutaneous aggressive epidermotropic CD8-positive cytotoxic T cell lymphoma
สำหรับเคสที่ไม่สามารถจัดเข้ากลุ่มที่กล่าวมาได้ จะใช้คำว่า
- Primary cutaneous peripheral T cell lymphoma (PTCL), not otherwise specified (NOS)
ข้อควรเน้นย้ำ:
เนื่องจากมี ลักษณะคลินิก-พยาธิวิทยา (clinicopathologic features) ที่ซ้อนทับกัน และ
ฟีโนไทป์ที่ผิดปกติอย่างมาก (highly aberrant phenotypes)
การแยกแยะ ระหว่าง CTCL ชนิดรุนแรงต่างๆ เหล่านี้ อาจทำได้ยากมากในบางกรณี
การวางระยะโรค (Staging)
นอกเหนือจาก CTCL (ซึ่งควรใช้คำนี้สำหรับมะเร็งต่อมน้ำเหลืองชนิดทีเซลล์ที่มีต้นกำเนิดจากผิวหนังเท่านั้น)
ยังมี มะเร็งต่อมน้ำเหลืองชนิดทีเซลล์ที่เกิดจากระบบอื่น (systemic T cell lymphomas)
ที่สามารถ แสดงอาการที่ผิวหนัง เป็นครั้งแรกหรือ กำเริบกลับมาในผิวหนัง ได้เช่นกัน
ดังนั้นจึงจำเป็นต้องมี กระบวนการวางระยะโรค (staging procedures) ที่เหมาะสม
เพื่อแยกแยะให้ได้ระหว่าง:
- CTCL ที่มีต้นกำเนิดจากผิวหนังจริงๆ
- กับมะเร็งต่อมน้ำเหลืองชนิด systemic ที่แพร่กระจายมาสู่ผิวหนัง
ขอบเขตของการวางระยะโรค จะขึ้นอยู่กับ:
- ชนิดของ CTCL ที่สงสัย
- และในกรณีของ classic MF จะขึ้นอยู่กับ ระยะทางคลินิกของโรค (clinical stage)
กรณีที่ ไม่จำเป็นต้องวางระยะโรคโดยละเอียด ได้แก่:
- MF ระยะเริ่มต้น (patch/plaque stage)
- Pagetoid reticulosis
- กรณีที่ชัดเจนของ Lymphomatoid papulosis (LyP)
- และอาจรวมถึงกรณีปกติของ:
- Primary cutaneous CD4-positive small/medium T cell lymphoproliferative disorder
- Primary cutaneous acral CD8-positive T cell lymphoproliferative disorder
ในกรณีเหล่านี้ การวางระยะโรค โดยละเอียดอาจไม่จำเป็น
กรณีที่ จำเป็นต้องวางระยะโรคอย่างละเอียด ได้แก่:
- กรณีสงสัยว่าเป็น Sézary syndrome (SS)
ควรเน้นการประเมินดังนี้: - การตรวจเซลล์เลือดโดย วิธีทางเซลล์วิทยา (cytology)
- การตรวจฟีโนไทป์เซลล์โดย flow cytometry
- การวิเคราะห์ TCR gene rearrangement
สำหรับ CTCL ชนิดอื่นๆ ทั้งหมด
ควรดำเนินการวางระยะโรคโดยมาตรฐานทางโลหิตวิทยา (routine hematologic staging) ได้แก่:
- การตรวจนับเม็ดเลือดสมบูรณ์ (Complete blood count, CBC) และตรวจแยกชนิดเม็ดเลือด (differential count)
- การตรวจเคมีในเลือด (serum chemistry panel)
- การทำ CT scan และ/หรือ PET scan ที่บริเวณทรวงอกและช่องท้อง
- และในกรณีส่วนใหญ่ ควรทำ การเจาะตัวอย่างไขกระดูก (bone marrow sampling)
สรุปสั้นๆ:
การวางระยะโรค CTCL ต้อง ปรับตามชนิดโรคและความรุนแรงทางคลินิก เพื่อให้แยกได้ระหว่าง CTCL แท้ กับ systemic lymphoma ที่แพร่สู่ผิวหนัง และเพื่อวางแผนการรักษาที่เหมาะสมที่สุด
Mycosis Fungoides (MF)
คำนิยาม (Definition)
Mycosis fungoides (MF) เป็นชนิดที่พบบ่อยที่สุดของ cutaneous T cell lymphoma (CTCL) และคิดเป็นประมาณ 50% ของมะเร็งต่อมน้ำเหลืองที่มีต้นกำเนิดจากผิวหนังทั้งหมด
คำว่า MF ควรสงวนไว้ใช้เฉพาะสำหรับ:
- ชนิด "Alibert–Bazin" แบบคลาสสิก
ซึ่งมีลักษณะเฉพาะคือการดำเนินโรคที่มีการเปลี่ยนแปลงลักษณะทางคลินิกจาก: - ปื้น (patches)
- ไปเป็น คราบหนา (plaques)
- และในที่สุดกลายเป็น ก้อนเนื้องอก (tumors)
- หรือสำหรับ ชนิดแปรผันทางคลินิกและพยาธิวิทยา (clinicopathologic variants) ที่มีการดำเนินโรคในลักษณะคล้ายกัน
ระบาดวิทยา (Epidemiology)
- อุบัติการณ์ของ MF ในสหรัฐอเมริกาคือประมาณ 0.4 รายต่อประชากร 100,000 คนต่อปี
- MF มักเกิดในผู้ใหญ่ช่วงอายุกลางคนถึงสูงวัย
(อายุเฉลี่ยขณะวินิจฉัยประมาณ 55–60 ปี) - อย่างไรก็ตาม MF ก็สามารถเกิดใน เด็กและวัยรุ่น ได้เช่นกัน
- ผู้ชายมีโอกาสเป็นโรคนี้มากกว่าผู้หญิง
อัตราส่วนชายต่อหญิงอยู่ที่ประมาณ 1.6–2.0 : 1
พยาธิกำเนิด (Pathogenesis)
- สาเหตุ (etiology) และ กลไกการเกิดโรค (pathogenetic mechanisms) ของ MF
รวมถึงกระบวนการดำเนินโรคแบบเป็นขั้นตอน (stepwise progression) ยังไม่เป็นที่เข้าใจอย่างชัดเจน - ปัจจัยที่ได้รับการพิจารณาว่าเกี่ยวข้อง ได้แก่:
- ปัจจัยทางพันธุกรรม (genetic factors)
- ปัจจัยสิ่งแวดล้อม (environmental factors)
- และปัจจัยทางภูมิคุ้มกัน (immunologic factors)
ปัจจัยทางพันธุกรรม (Genetic Factors)
กระบวนการเกิดมะเร็งต่อมน้ำเหลือง (lymphomagenesis) ถือเป็นกระบวนการที่มีหลายปัจจัยเกี่ยวข้อง
โดยมีการสะสมความผิดปกติทางพันธุกรรม อย่างเป็นขั้นตอน
นำไปสู่
- การเพิ่มจำนวนของเซลล์แบบโคลนเดียว (clonal proliferation)
- การกลายเป็นเซลล์มะเร็ง (malignant transformation)
- และในที่สุดกลายเป็นโรคที่ ลุกลามและแพร่กระจายอย่างกว้างขวาง
แม้ว่าลำดับของการดำเนินโรคทางคลินิก (clinical progression)
ใน MF จะถูกบรรยายมาตั้งแต่กว่า 100 ปีที่แล้ว
แต่เหตุการณ์ระดับโมเลกุลที่เกี่ยวข้องกับแต่ละขั้นตอนของการลุกลามของเนื้องอก
ยังไม่ได้รับการระบุอย่างสมบูรณ์
ข้อมูลจากการศึกษาการแสดงออกของยีน (gene expression studies) ใน MF ระยะเริ่มต้น พบว่า:
- มีการแสดงออกมากเกินไป (overexpression) ของ
- Transcription factor TOX
- และ PDCD1 (PD-1)
ซึ่งสามารถใช้เป็น เครื่องหมายช่วยวินิจฉัย ได้
ใน MF ระยะก้อนเนื้องอก (tumor stage MF)
พบว่า:
- มักมีคาริโอไทป์ที่ซับซ้อน (complex karyotypes)
- การกลายพันธุ์ส่วนใหญ่เกิดจากการเปลี่ยนแปลงจำนวนสำเนาของยีน (somatic copy-number variants)
ข้อมูลจากการทำ Whole-genome sequencing และ RNA sequencing ใน MF ระยะก้อนเนื้องอก แสดงให้เห็นว่า:
- มีการเรียงตัวผิดปกติ (rearrangements) ในยีนหลายตัว
ซึ่งเกี่ยวข้องกับ - การควบคุมการถอดรหัส (transcriptional regulation)
- และการส่งสัญญาณเซลล์ (signal transduction)
ความผิดปกติที่พบบ่อยที่สุดใน MF ได้แก่:
- การลบ (deletion) ของ HNRNPK และ SOCS1
(ซึ่งเป็นยีนที่สร้างตัวต้านการส่งสัญญาณของเส้นทาง JAK-STAT)
โดยการลบ HNRNPK และ SOCS1 นี้
เป็นความผิดปกติที่พบบ่อยเป็นอันดับสอง รองจากการลบ CDKN2A
ผลกระทบทางคลินิกที่สำคัญ:
- การลบหรือการทำให้ CDKN2A สูญเสียการทำงาน มีความสัมพันธ์กับ การรอดชีวิตที่สั้นลง ในผู้ป่วย MF ระยะก้อนเนื้องอก
- การลบ HNRNPK และ SOCS1 อาจทำให้มีการกระตุ้น STAT3 อย่างต่อเนื่อง (constitutive activation)
บทบาทของ Staphylococcus aureus ใน MF
Staphylococcus aureus และ สารพิษของมัน (toxins)
สามารถ:
- กระตุ้นการส่งสัญญาณ STAT3
- เพิ่มการแสดงออกของ interleukin-2 receptor (IL-2R)
ในทั้งเซลล์เนื้องอกและทีเซลล์ที่ไม่ใช่มะเร็ง
ส่งผลให้ กระตุ้นการเพิ่มจำนวนของเซลล์เนื้องอกใน CTCL
การรักษาด้วยยาปฏิชีวนะอย่างจริงจัง สามารถ:
- กำจัดสิ่งกระตุ้นนี้ได้อย่างมีประสิทธิภาพ
- ฟื้นฟูสภาวะแวดล้อมในเนื้องอก (normalize the tumor microenvironment)
- ยับยั้งการส่งสัญญาณ STAT3 และการเพิ่มจำนวนของเซลล์ในรอยโรค
- นำไปสู่ การปรับปรุงอาการทางคลินิกอย่างมีนัยสำคัญ ทั้งใน MF และ Sézary syndrome
นอกจากนี้
- Staphylococcus aureus α-toxin ยังสามารถ
- ยับยั้งการฆ่าเซลล์มะเร็งโดยทีเซลล์ CD8+
- ช่วยให้เซลล์มะเร็ง หลบเลี่ยงระบบภูมิคุ้มกัน และ เพิ่มจำนวนได้อย่างต่อเนื่อง
ปัจจัยทางสิ่งแวดล้อม (Environmental Factors)
การกระตุ้นระบบภูมิคุ้มกันแบบเรื้อรัง (persistent antigenic stimulation)
ได้รับการพิสูจน์แล้วว่ามีบทบาทสำคัญในการก่อเกิดมะเร็งต่อมน้ำเหลืองหลายชนิด เช่น
- MALT lymphomas (เกี่ยวข้องกับการติดเชื้อ Helicobacter pylori)
- Cutaneous B cell lymphoma (CBCL) (เกี่ยวข้องกับการติดเชื้อ Borrelia burgdorferi)
- และ Enteropathy-type T cell lymphoma (เกี่ยวข้องกับ โรคเซลิแอค - celiac disease)
สำหรับใน MF เอง
- มีการเสนอว่า การกระตุ้นภูมิคุ้มกันแบบเรื้อรัง อาจเป็นเหตุการณ์ตั้งต้นที่ก่อโรค
- แต่ ลักษณะของแอนติเจน (antigen) ที่เกี่ยวข้อง ยังไม่ทราบแน่ชัด
จากการศึกษาขนาดใหญ่แบบ case-control พบว่า:
- มี ความสัมพันธ์ ระหว่างการสัมผัสสารอุตสาหกรรมหรือสิ่งแวดล้อมกับการเกิด MF
- แต่ บทบาทที่แท้จริง ของปัจจัยเหล่านี้ยังคงเป็นที่ ถกเถียง
ในขณะที่:
- บทบาทของ HTLV-1 ในการก่อ Adult T cell leukemia/lymphoma
- และบทบาทของ EBV ในการก่อ nasal NK/T cell lymphoma
ได้รับการยืนยันแล้วอย่างแน่นอน
แต่สำหรับ MF ยัง ไม่มีหลักฐานที่แน่ชัด ว่าไวรัสเหล่านี้หรือไวรัสชนิดอื่นมีบทบาทสาเหตุหลัก
ปัจจัยทางภูมิคุ้มกัน (Immunologic Factors)
CD8+ cytotoxic T cells (CTLs)
เชื่อว่ามีบทบาทสำคัญในการตอบสนองต่อต้านเนื้องอกใน MF
มีรายงานว่า:
- เปอร์เซ็นต์ที่สูง ของ CD8+ CTLs ในรอยโรคผิวหนัง (dermal infiltrates)
มีความสัมพันธ์กับ การรอดชีวิตที่ดีขึ้น
กลไกการทำลายเซลล์มะเร็งของ CD8+ T cells มี 2 วิธีหลัก:
- โดยตรง (direct cytotoxic effect):
- ผ่านการหลั่งสารในไซโตพลาสซึม (cytotoxic granules) ที่มี
- Perforin
- Granzymes
- และ TIA-1 (T cell-restricted intracellular antigen)
- ผ่าน Fas-FasL pathway:
- โดยการแสดงออกของ Fas ligand (FasL) บน CD8+ T cells
- ซึ่งจะจับกับ Fas receptor (CD95; APO-1) บนเซลล์มะเร็ง
ทั้งสองเส้นทางนำไปสู่:
- การกระตุ้น caspase 3
- และ การตายของเซลล์เนื้องอก
อย่างไรก็ตาม
- การที่เซลล์มะเร็ง สูญเสียการแสดงออกหรือหน้าที่ของ Fas
- เป็นหนึ่งใน กลไกที่เซลล์มะเร็งใช้หลบเลี่ยงการทำลายของระบบภูมิคุ้มกัน
ในผู้ป่วยส่วนใหญ่:
- เซลล์มะเร็งใน Sézary syndrome (SS) และใน MF ระยะก้อนเนื้องอก
มีต้นกำเนิดจาก CD4+ T cells ที่มีลักษณะการสร้างไซโตไคน์แบบ Th2 (สร้าง IL-4, IL-5, และ IL-10)
ในขณะที่:
- CD8+ T cells คือแหล่งสำคัญของการสร้าง IFN-γ
ซึ่งมีบทบาทสำคัญในการเสริมการทำลายเซลล์โดย T cells และ NK cells
ตามแนวคิดนี้:
- มีการเสนอว่า MF patches และ plaques จะมีลักษณะ type 1 cytokine profile เด่น (เน้น IFN-γ)
- แต่เมื่อโรคพัฒนาสู่ MF tumors จะเปลี่ยนไปมีลักษณะ type 2 cytokine profile เด่น (เน้น IL-4, IL-5, IL-10)
ผลกระทบทางคลินิก:
- การเพิ่มขึ้นของระดับไซโตไคน์แบบ Th2
อาจ ยับยั้งการตอบสนองต่อต้านเนื้องอกที่พึ่งพา Th1 cells - และมีส่วนในการก่อให้เกิด ภาวะภูมิคุ้มกันบกพร่อง (immunosuppression)
ที่พบในผู้ป่วย MF ระยะลุกลาม
· ลักษณะทางคลินิก (Clinical Features)
· โดยลักษณะทั่วไปแล้ว ผู้ป่วย mycosis fungoides (MF) แบบคลาสสิก
จะมีการดำเนินโรคจาก:
- ระยะปื้น (patch stage) →
- ระยะคราบหนา (plaque stage) →
- และในที่สุดเข้าสู่ ระยะก้อนเนื้องอก (tumor stage)
โดยกระบวนการเปลี่ยนแปลงนี้มักจะเป็นไปอย่าง ช้าๆ ต่อเนื่องนานหลายปีหรือแม้กระทั่งหลายสิบปี
ก่อนที่จะสามารถวินิจฉัย MF ได้อย่างชัดเจน:
- ผู้ป่วยมักจะมี ผื่นผิวหนังแบบเรื้อรัง ที่มีลักษณะไม่จำเพาะ (nonspecific)
เช่น ลักษณะคล้าย ผื่นผิวหนังอักเสบ (eczema) หรือ สะเก็ดเงิน (psoriasis-like lesions) - และเมื่อทำการตัดชิ้นเนื้อ (biopsy) ในระยะแรกๆ ก็มักจะได้ผลที่ ไม่สามารถสรุปการวินิจฉัยได้ (non-diagnostic)
ระยะเวลาเฉลี่ย ตั้งแต่เริ่มมีรอยโรคผิวหนังจนถึงการวินิจฉัย MF คือประมาณ 4–6 ปี
แต่ในบางราย:
- อาจใช้เวลาแค่ไม่กี่เดือน
- หรืออาจยาวนาน มากกว่าห้าทศวรรษ
ลักษณะของระยะเริ่มต้น (Early patch stage MF)
- มีลักษณะเป็น ผื่นแดง (erythematous) ขนาดต่างๆ กัน
- ผื่นมี ขุยละเอียด (finely scaling)
- และอาจมี อาการคันเล็กน้อย
รอยโรคระยะแรกอาจมี:
- ระดับของการฝ่อของผิวหนัง (atrophy) ต่างกัน
- หรือในบางกรณีอาจปรากฏเป็น poikilodermatous variant
(คือ รอยปื้นที่มีการกระจายตัวของ - สีผิวเข้มกว่าปกติ (hyperpigmentation)
- สีผิวจางลง (hypopigmentation)
- การฝ่อของผิวหนัง (atrophy)
- และหลอดเลือดฝอยขยายตัว (telangiectasia))
ซึ่งก่อนหน้านี้เคยถูกเรียกว่า poikiloderma vasculare atrophicans
ในผู้ป่วยที่มีผิวเข้ม:
- อาจพบ รอยโรคแบบสีจางลง (hypopigmented lesions) อย่างกว้างขวางได้
- และลักษณะนี้ยังพบได้บ่อยในกรณีของ MF ที่เริ่มเป็นตั้งแต่วัยเด็ก (juvenile-onset MF) ด้วย
เมื่อเริ่มต้น รอยโรคที่ผิวหนังในระยะแรก
มักมี ตำแหน่งที่พบได้บ่อย คือ:
- บริเวณก้น (buttocks)
- และบริเวณที่ถูกคลุมด้วยเสื้อผ้า เช่น ลำตัวและแขนขา
เมื่อโรคดำเนินไป:
- จะมีการพัฒนาของ แผ่นคราบสีแดงน้ำตาล (reddish-brown plaques) ที่มีการแทรกซึมมากขึ้น
- ผื่นเหล่านี้จะค่อยๆ ขยายขนาด และอาจมีรูปร่างแบบ:
- วงแหวน (annular)
- หลายวงซ้อนกัน (polycyclic)
- หรือรูปร่างคล้าย เกือกม้า (horseshoe-shaped)
ข้อสำคัญ:
- ผู้ป่วย หลายราย จะหยุดอยู่แค่ ระยะ plaque และ ไม่พัฒนาไปไกลกว่านี้
- อย่างไรก็ตาม ผู้ป่วยส่วนน้อย อาจพัฒนาเป็น:
- ก้อนเนื้อ (nodules)
- หรือเนื้องอก (tumors)
ผู้ป่วยที่อยู่ใน ระยะก้อนเนื้องอกของ MF (tumor stage MF)
มักแสดงรอยโรคแบบผสมผสานระหว่าง:
- ปื้น (patches)
- แผ่นหนา (plaques)
- และ ก้อนเนื้อหรือตุ่มเนื้อ (tumors)
โดยก้อนเนื้อเหล่านี้:
- มักมีการ แตกเป็นแผล (ulceration) ด้วย
ข้อสังเกตสำคัญ:
- หากพบเพียง ก้อนเนื้อที่ผิวหนัง โดยไม่มี ปื้น หรือ แผ่นหนา นำมาก่อนหรือร่วมด้วย
- การวินิจฉัยว่าเป็น MF จะมีความเป็นไปได้ต่ำมาก
- และควรพิจารณาว่าอาจเป็น CTCL ชนิดอื่นแทน
ความเสี่ยงในการเกิดโรคนอกผิวหนัง (extracutaneous disease)
มีความสัมพันธ์กับ:
- ขนาด (extent)
- และ ชนิดของรอยโรคผิวหนัง (type of skin lesions)
โดยแบ่งได้ดังนี้:
- พบได้ยากมาก ในผู้ป่วยที่มีแค่ patch/plaque แบบจำกัดพื้นที่
- ค่อนข้างไม่บ่อย ในผู้ป่วยที่มี plaque กระจายทั่วตัว
- พบได้บ่อยที่สุด ในผู้ป่วยที่มี:
- ก้อนเนื้อ (skin tumors)
- หรือ ผื่นแดงทั่วตัว (erythroderma)
ลักษณะการแพร่กระจายของโรค:
- ระยะแรกของการแพร่กระจายนอกผิวหนัง
มักเริ่มที่ ต่อมน้ำเหลืองบริเวณใกล้เคียง ซึ่งระบายน้ำเหลืองจากพื้นที่ผิวหนังที่มีรอยโรคกว้างขวาง - หลังจากนั้น อาจมีการลุกลามไปยัง อวัยวะภายในต่างๆ ได้ทุกชนิด
- อย่างไรก็ตาม การแพร่กระจายไปที่ไขกระดูก
ถือว่า พบได้ค่อนข้างน้อย
พยาธิวิทยา (Pathology)
ระยะปื้นเริ่มต้น (Early patch lesions)
ในระยะเริ่มต้นของ mycosis fungoides (MF)
- รอยโรคปื้น (patch lesions) จะมี การแทรกซึมของเซลล์แบบตื้นๆ เป็นแถบ (superficial band-like infiltrates) หรือคล้าย lichen planus (lichenoid infiltrates)
- ซึ่งประกอบไปด้วย ลิมโฟไซต์ (lymphocytes) เป็นหลัก
ลักษณะของเซลล์ผิดปกติ (atypical cells):
- มีขนาด เล็กถึงปานกลาง
- นิวเคลียสมีลักษณะ บิดเบี้ยวอย่างมาก (cerebriform)
และบางครั้งมี การย้อมติดสีเข้มผิดปกติ (hyperchromatic nuclei) - จำนวนเซลล์ผิดปกติมักมีไม่มาก
- และส่วนใหญ่จะจำกัดอยู่ที่ ชั้นหนังกำพร้า (epidermotropism)
รูปแบบการวางตัวของลิมโฟไซต์ในหนังกำพร้า:
- ลิมโฟไซต์จะ เกาะกลุ่มอยู่ในชั้นฐานของหนังกำพร้า (basal layer)
- ล้อมรอบด้วย ขอบสุญญากาศ (vacuolated halos)
- มักเรียงตัวในรูปแบบ เป็นเส้นตรง (linear configuration)
ระยะคราบหนา (Plaques)
- Epidermotropism มีความเด่นชัดมากขึ้นในระยะ plaque
- พบการก่อตัวของ กลุ่มเซลล์ผิดปกติภายในหนังกำพร้า (intraepidermal nests)
ซึ่งเรียกว่า Pautrier microabscesses (แม้จริงๆ แล้วจะมีการบรรยายครั้งแรกโดย Darier)
หมายเหตุ:
- การพบ Pautrier microabscesses เป็นลักษณะจำเพาะสูงของ MF
- แต่พบได้เพียงใน ส่วนน้อย ของผู้ป่วย
การเปลี่ยนแปลงอื่นในหนังกำพร้า (epidermis):
- อาจพบ acanthosis (หนังกำพร้าหนาขึ้น)
- และ rete ridges ที่ยาวขึ้น
- แต่ spongiosis (ภาวะน้ำคั่งระหว่างเซลล์) มักพบ เล็กน้อยหรือไม่มีเลย
การแทรกซึมในชั้นหนังแท้ (dermal infiltrates):
- มีความชัดเจนมากขึ้น
- อาจมี:
- เซลล์ผิดปกติที่มีนิวเคลียส cerebriform จำนวนมากขึ้น
- เซลล์ blast cells บางส่วน
- และการผสมของ eosinophils และ plasma cells
รูปแบบพิเศษ:
ในบางกรณีหายาก อาจพบการแทรกซึมแบบ interstitial pattern ซึ่งคล้าย morphea (เรียกว่า interstitial MF)
ระยะก้อนเนื้องอก (Progression to Tumor Stage MF)
- การแทรกซึมของเซลล์มะเร็งในชั้นหนังแท้ (dermal infiltrates)
สามารถลุกลามทั่วทั้งชั้นหนังแท้ และ ลามลงสู่ชั้นไขมันใต้ผิวหนัง (subcutaneous tissue) ได้ - Epidermotropism มัก หายไป ในระยะนี้
ลักษณะของเซลล์ในระยะก้อนเนื้องอก:
- จำนวนเซลล์มะเร็ง เพิ่มขึ้นอย่างมาก
- เซลล์มีขนาดที่หลากหลาย ได้แก่:
- เซลล์เล็ก
- เซลล์ขนาดกลาง
- เซลล์ขนาดใหญ่
- ทั้งหมดมีลักษณะ nucleus แบบ cerebriform
นอกจากนี้ยังพบ: - เซลล์ blast cells ที่มีนิวเคลียสเด่นชัด
- และเซลล์ในระยะก้ำกึ่ง (intermediate forms)
การเปลี่ยนแปลงเป็นเซลล์ขนาดใหญ่ (Large Cell Transformation)
- หมายถึง การมี เซลล์ขนาดใหญ่ที่เป็น CD30-negative หรือ CD30-positive
เกินกว่า 25% ของการแทรกซึม หรือมีการสร้าง microscopic nodules
ความหมายทางพยากรณ์โรค:
- โดยทั่วไป การเกิด large cell transformation
มีความสัมพันธ์กับ พยากรณ์โรคที่แย่ลง
อย่างไรก็ตาม:
- ในกลุ่มผู้ป่วยที่มี CD30-positive large cells
มีพยากรณ์โรคที่ดีกว่า ผู้ป่วยที่มี CD30-negative large cells
ลักษณะภูมิคุ้มกันวิทยา (Immunophenotype)
เซลล์มะเร็งใน Mycosis Fungoides (MF)
มีลักษณะฟีโนไทป์ของ T cell ความจำ (memory T cell) ดังนี้:
- CD3+
- CD4+
- CD45RO+
- และ CD8−
ใน ผู้ป่วยส่วนน้อย ที่มีลักษณะทางคลินิกเป็น MF แบบคลาสสิก อาจพบ:
- ฟีโนไทป์ CD3+, CD4−, CD8+ (mature T cells)
- หรือพบได้ยิ่งน้อยกว่านั้น คือมีฟีโนไทป์ของ γ/δ T cells ได้แก่
- βF1− (ไม่แสดง marker ของ α/β TCR)
- TCRγ/δ+
- CD3+
- CD4−
- CD8+
ผู้ป่วยกลุ่มนี้:
- มีพฤติกรรมทางคลินิกและพยากรณ์โรค เหมือนกับผู้ป่วย CD4+ MF
- จึงไม่ควรแยกกลุ่มออกมาต่างหาก
การแสดงฟีโนไทป์ผิดปกติ (aberrant phenotype)
เช่น:
- การสูญเสียการแสดงออกของ pan-T cell antigens (เช่น CD2, CD3, CD5)
ถือเป็น เครื่องมือเสริมที่สำคัญ ในการวินิจฉัย MF
แต่โดยทั่วไปแล้ว พบน้อย ในระยะเริ่มต้นของโรค
ฟีโนไทป์ CD8+ T cell
พบได้บ่อยกว่าใน:
- MF ในเด็ก (pediatric MF)
- และใน MF ชนิดพิเศษบางแบบ เช่น
- Hypopigmented MF (ผิวจาง)
- Hyperpigmented MF (ผิวคล้ำ)
- หรือ Poikilodermatous MF
การวินิจฉัยแยกโรค (Differential Diagnosis)
การวินิจฉัยแยกโรค MF แบ่งเป็น 3 กลุ่มหลัก:
1. กลุ่มโรคผิวหนังอักเสบชนิดไม่ร้ายแรง (Benign dermatoses)
- MF ระยะเริ่มต้น อาจมีลักษณะคลินิก คล้าย โรคผิวหนังที่ไม่ร้ายแรงหลายชนิด เช่น:
- ผื่นผิวหนังอักเสบชนิดต่างๆ (eczema)
- สะเก็ดเงิน (psoriasis)
- การติดเชื้อราในผิวหนัง (superficial fungal infections)
- หรือปฏิกิริยาต่อยา (drug reactions)
ข้อสังเกต:
- โรคเหล่านี้สามารถ ตัดออกได้ โดยอาศัยการตรวจทางจุลพยาธิวิทยา (histology) และการตรวจผิวหนังมาตรฐานอื่นๆ
นอกจากนี้:
- อาจรวมถึงผู้ป่วยที่มี large plaque parapsoriasis (parapsoriasis en plaque)
ซึ่งแสดงรอยโรคเป็น: - ปื้นหรือคราบแดงเล็กน้อยที่มีขุย และบางครั้งมีลักษณะ ฝ่อ
- โดยมักพบที่ ลำตัว และ ก้น
ข้อสังเกตสำคัญ:
- Large plaque parapsoriasis ไม่สามารถแยกทางคลินิกออกจาก MF ระยะปื้นหรือคราบหนา ได้
- แต่ในทางจุลพยาธิวิทยา มักจะ ไม่สอดคล้องกับลักษณะของ MF
- การศึกษาติดตามระยะยาวพบว่า ~10% ของผู้ป่วย large plaque parapsoriasis จะพัฒนาไปเป็น MF ที่ชัดเจน
ข้อถกเถียง:
- มีความเห็นแตกต่างกันว่า:
- บางกลุ่มเสนอว่า large plaque parapsoriasis ควรถือเป็น รูปแบบหนึ่งของ MF
- แต่ก็ยังไม่มี ฉันทามติที่แน่ชัด (consensus)
ในทางตรงกันข้าม:
- มี ฉันทามติชัดเจนมากกว่า ว่า small plaque parapsoriasis
ไม่ใช่ MF
2. กลุ่มโรคผิวหนังอักเสบที่มีลักษณะทางจุลพยาธิวิทยาคล้าย MF
ตัวอย่าง ได้แก่:
- Lymphomatoid contact dermatitis
- Lymphomatoid drug reactions
- และ Actinic reticuloid
ข้อสังเกต:
- ถึงแม้จะมีลักษณะทางจุลพยาธิวิทยาคล้าย MF
แต่มีความแตกต่างบางอย่าง เช่น: - ใน MF แท้ เซลล์ผิดปกติจะกระจายอยู่ใน หนังกำพร้า
- ในขณะที่ในโรคกลุ่มนี้เซลล์ผิดปกติจะกระจายอยู่ ในหนังแท้ มากกว่า
การประเมินลักษณะทางคลินิกอย่างระมัดระวัง:
- ซึ่งมัก ไม่สอดคล้องกับ MF
- มักช่วยให้สามารถวินิจฉัยแยกโรคได้ถูกต้อง
3. กลุ่มมะเร็งต่อมน้ำเหลืองทีเซลล์ชนิดอื่น (Other types of epidermotropic CTCL)
- มะเร็งต่อมน้ำเหลืองที่แทรกซึมหนังกำพร้า (epidermotropic CTCL) อื่นๆ
บางชนิดอาจมีลักษณะทางจุลพยาธิวิทยาคล้าย MF - ลักษณะจำแนกโรคเหล่านี้ ได้นำเสนอไว้ใน ตารางที่ 1
ระบบการแบ่งระยะโรคและกระบวนการวางระยะโรค (Staging Systems and Staging Procedures)
การวางระยะโรคในผู้ป่วย Mycosis Fungoides (MF) และ Sézary Syndrome (SS)
มีความสำคัญอย่างยิ่ง เพราะ:
- มีผลโดยตรงต่อ การวางแผนการดูแลรักษาและการเลือกแนวทางการรักษา
- และยังมี ความหมายต่อการพยากรณ์โรค (prognosis) อีกด้วย
ในปี ค.ศ. 2007
ได้มีการเสนอ ระบบการแบ่งระยะทางคลินิก (clinical staging system) ฉบับปรับปรุงสำหรับ MF และ SS
ซึ่งอ้างอิงตามหลักของระบบ TNM (Tumor–Node–Metastasis)
โดยระบบนี้พิจารณาองค์ประกอบสำคัญ 4 ส่วน ได้แก่:
- ชนิดและขนาดของรอยโรคผิวหนัง (T1–T4)
- การมีหรือไม่มีการแพร่กระจายไปต่อมน้ำเหลือง (N0–N3)
- การมีหรือไม่มีการแพร่กระจายสู่อวัยวะภายใน (M0–M1)
- การมีหรือไม่มีการแพร่กระจายสู่กระแสเลือด (B0–B2)
(ดูรายละเอียดเพิ่มเติมใน ตารางที่ 2 และ 3)
สรุปสั้นๆ:
- T = ลักษณะและขนาดของรอยโรคที่ผิวหนัง
- N = สถานะของต่อมน้ำเหลือง
- M = การแพร่กระจายสู่อวัยวะภายใน
- B = การแพร่กระจายสู่กระแสเลือด
ระบบ TNMB นี้
ช่วยให้สามารถแบ่งระยะโรคได้แม่นยำยิ่งขึ้น และช่วยกำหนดกลุ่มความเสี่ยงเพื่อวางแผนการรักษาเฉพาะรายได้ดียิ่งขึ้น
ตารางที่ 2
การจำแนกระบบ TNMB ของ Mycosis Fungoides และ Sézary Syndrome
|
หมวดหมู่ |
รายละเอียดการจำแนก |
คำอธิบาย |
|
T (ผิวหนัง) |
||
|
T1 |
รอยโรคปื้น/คราบหนาแบบจำกัด |
เกิดขึ้นน้อยกว่า 10% ของพื้นที่ผิวหนังทั้งหมด |
|
T2 |
รอยโรคปื้น/คราบหนาแบบกระจายทั่วไป |
เกิดขึ้นตั้งแต่ 10% หรือมากกว่าของพื้นที่ผิวหนังทั้งหมด |
|
T3 |
ก้อนเนื้องอก |
มีลักษณะเป็นก้อนเนื้องอกบนผิวหนัง |
|
T4 |
ผื่นแดงทั่วตัว (erythroderma) |
ผิวหนังแดงกระจายทั่วร่างกาย |
|
หมวดหมู่ |
รายละเอียดการจำแนก |
คำอธิบาย |
|
N (ต่อมน้ำเหลือง) |
||
|
N0 |
ไม่มีต่อมน้ำเหลืองโต |
ไม่พบการโตของต่อมน้ำเหลืองทางคลินิก |
|
N1 |
ต่อมน้ำเหลืองโต แต่ผลตรวจชิ้นเนื้อไม่พบเซลล์มะเร็ง |
โครงสร้างต่อมน้ำเหลืองยังปกติ (nodal architecture ไม่ถูกทำลาย) |
|
N2 |
ต่อมน้ำเหลืองโต และผลตรวจชิ้นเนื้อพบการแทรกซึมของมะเร็ง |
โครงสร้างต่อมน้ำเหลืองยังไม่ถูกทำลาย (nodal architecture ยังสมบูรณ์) |
|
N3 |
ต่อมน้ำเหลืองโต และผลตรวจชิ้นเนื้อพบการแทรกซึมของมะเร็งอย่างชัดเจน |
โครงสร้างต่อมน้ำเหลืองถูกทำลายหรือเสียรูปบางส่วนหรือทั้งหมด (partially/fully effaced) |
|
Nx |
มีต่อมน้ำเหลืองผิดปกติทางคลินิก แต่ยังไม่ได้ยืนยันผลทางพยาธิวิทยา |
ยังไม่มีผลตรวจชิ้นเนื้อยืนยัน |
|
หมวดหมู่ |
รายละเอียดการจำแนก |
คำอธิบาย |
|
M (อวัยวะภายใน) |
||
|
M0 |
ไม่มีการลุกลามสู่อวัยวะภายใน |
ไม่พบการแพร่กระจายสู่อวัยวะภายใน |
|
M1 |
มีการลุกลามสู่อวัยวะภายใน |
พบการแพร่กระจายของโรคสู่อวัยวะภายใน |
|
หมวดหมู่ |
รายละเอียดการจำแนก |
คำอธิบาย |
|
B (เลือด) |
||
|
B0 |
ไม่มีการแพร่กระจายของเซลล์ผิดปกติอย่างมีนัยสำคัญในเลือด |
เซลล์ผิดปกติชนิด Sézary cells มีน้อยกว่า 5% ของลิมโฟไซต์ในเลือดส่วนปลาย |
|
B1 |
มีปริมาณเซลล์มะเร็งในเลือดระดับต่ำ |
พบเซลล์ผิดปกติ Sézary cells มากกว่า 5% ของลิมโฟไซต์ในเลือดส่วนปลาย แต่ยังไม่เข้าเกณฑ์ B2 |
|
B2 |
มีปริมาณเซลล์มะเร็งในเลือดระดับสูง |
พบการกลายพันธุ์แบบโคลนบวก (clone positive) และอย่างน้อยหนึ่งในเงื่อนไขต่อไปนี้: |
หมายเหตุสรุป:
- ระบบ TNMB นี้ ครอบคลุมทั้งสถานะของ ผิวหนัง, ต่อมน้ำเหลือง, การแพร่กระจายสู่อวัยวะภายใน, และ เลือด
- ใช้เป็นมาตรฐานในการประเมิน ระยะโรค, วางแผนรักษา, และ ประเมินพยากรณ์โรค สำหรับผู้ป่วย MF และ SS
ตารางที่ 3
ระบบแบ่งระยะทางคลินิกของโรค Mycosis Fungoides และ Sézary Syndrome
|
ระยะทางคลินิก (Clinical Stage) |
T (รอยโรคที่ผิวหนัง) |
N (ต่อมน้ำเหลือง) |
M (อวัยวะภายใน) |
B (เลือด) |
|
IA |
T₁ (รอยโรคจำกัด <10%) |
N₀ (ไม่โต) |
M₀ (ไม่มีแพร่กระจาย) |
B₀–₁ (ไม่มีหรือเล็กน้อย) |
|
IB |
T₂ (รอยโรค ≥10%) |
N₀ |
M₀ |
B₀–₁ |
|
IIA |
T₁–₂ |
N₁–₂ (โต, ไม่เสียโครงสร้าง) |
M₀ |
B₀–₁ |
|
IIB |
T₃ (มี tumor) |
N₀–₁ |
M₀ |
B₀–₁ |
|
III |
T₄ (erythroderma) |
N₀–₂ |
M₀ |
B₀–₁ |
|
IVA₁ |
T₁–₄ |
N₀–₂ |
M₀ |
B₂ (แพร่กระจายในเลือด) |
|
IVA₂ |
T₁–₄ |
N₃ (โต, โครงสร้างเสีย) |
M₀ |
B₀–₂ |
|
IVB |
T₁–₄ |
N₀–₃ |
M₁ (มีการแพร่กระจายสู่อวัยวะภายใน) |
B₀–₂ |
คำอธิบายเพิ่มเติม:
- T (Tumor):
- T₁: ปื้น/คราบบาง <10% ของพื้นที่ผิว
- T₂: ปื้น/คราบหนา ≥10%
- T₃: มีก้อนเนื้องอก (tumors)
- T₄: erythroderma
- N (Node):
- N₀: ไม่มีต่อมน้ำเหลืองโต
- N₁–₂: โตแต่ยังไม่เสียโครงสร้าง
- N₃: โตและโครงสร้างต่อมน้ำเหลืองถูกทำลาย
- M (Metastasis):
- M₀: ไม่มีการลุกลามไปสู่อวัยวะภายใน
- M₁: มีการลุกลามสู่อวัยวะภายใน
- B (Blood):
- B₀: ไม่มี Sézary cells หรือมีน้อย
- B₁: มี Sézary cells >5% แต่ยังไม่เข้าเกณฑ์ B₂
- B₂: มี tumor burden สูงในเลือด (เช่น Sézary cells ≥1,000/mcl, CD4/CD8 >10 เป็นต้น)
การประเมินผู้ป่วยที่สงสัยว่าเป็น Mycosis Fungoides (MF)
การประเมินผู้ป่วยที่สงสัยว่าเป็น MF ควรประกอบด้วย:
- การตรวจร่างกายอย่างละเอียด
โดยให้ความสำคัญเป็นพิเศษกับ: - ชนิด (type) และขอบเขต (extent) ของรอยโรคผิวหนัง
- การคลำพบต่อมน้ำเหลืองโตหรือไม่
- การตัดชิ้นเนื้อผิวหนัง (skin biopsies)
- การตรวจนับเม็ดเลือดอย่างสมบูรณ์ (Complete Blood Counts, CBC)
- การตรวจเคมีในเลือด (Serum Chemistries)
ข้อปฏิบัติเพิ่มเติม:
- หากคลำได้ต่อมน้ำเหลืองโต
ควร ทำการตัดชิ้นเนื้อต่อมน้ำเหลืองเพื่อตรวจทางจุลพยาธิวิทยา (lymph node biopsy) - ผลทางจุลพยาธิวิทยาของต่อมน้ำเหลือง
สามารถช่วยจำแนกได้เป็น 3 กลุ่ม:
1. N1:
ต่อมน้ำเหลืองแสดงภาวะ dermatopathic lymphadenopathy
(มีการเปลี่ยนแปลงที่เกิดจากการตอบสนองทางผิวหนัง)
แต่ยังไม่มีการแทรกซึมของเซลล์ MF
2. N2:
ต่อมน้ำเหลืองแสดงภาวะ dermatopathic lymphadenopathy
ร่วมกับการแทรกซึมของเซลล์ MF ระยะเริ่มต้น
3. N3:
ต่อมน้ำเหลืองที่มี โครงสร้างถูกทำลาย
(nodal architecture effaced)
โดยเซลล์ T ที่ผิดปกติจากมะเร็ง
ความสำคัญ:
การจำแนกต่อมน้ำเหลืองออกเป็นกลุ่ม N1, N2, และ N3 นี้
มี ความสัมพันธ์อย่างชัดเจนกับพยากรณ์โรค (prognostic significance)
ข้อแนะนำเพิ่มเติมสำหรับการตรวจเพิ่มเติม:
- ในผู้ป่วยที่อยู่ใน ระยะ IA–IB
ไม่แนะนำ ให้ทำการตรวจเพิ่มเติมใดๆ เกินจากที่กล่าวข้างต้น - การทำ CT scan หรือ PET-CT ของทรวงอกและช่องท้อง
แนะนำเฉพาะในกรณีที่: - มีข้อสงสัยว่ามีการลุกลามนอกผิวหนัง (extracutaneous disease)
- อย่างไรก็ตาม
การทำ CT หรือ PET-CT
มีประโยชน์น้อย ในผู้ป่วยที่มีเพียง: - รอยโรคจำกัดเฉพาะปื้น (patches)
- หรือคราบหนา (plaques)
โดยไม่มีต่อมน้ำเหลืองโต - การตรวจอวัยวะอื่นๆ รวมถึง การเจาะไขกระดูก (bone marrow examination)
ควรทำเฉพาะในกรณีที่มีข้อบ่งชี้ทางคลินิกชัดเจนเท่านั้น
การรักษา (Treatment)
การเลือกแนวทางรักษาเบื้องต้นในผู้ป่วย Mycosis Fungoides (MF)
ขึ้นอยู่กับ:
- ระยะของโรค (stage of the disease)
- สภาพร่างกายทั่วไป และ
- อายุของผู้ป่วย
เนื่องจาก MF เป็นโรคที่มีลักษณะ เรื้อรังและเป็นซ้ำได้ (chronic and recurrent)
เป้าหมายของการรักษา จึงควรมุ่งเน้นที่:
- การ บรรเทาอาการ ของผู้ป่วย
- พร้อมกับ จำกัดความเป็นพิษจากการรักษา (toxicity) ให้ได้มากที่สุด
แนวทางการรักษาตามระยะโรค (Stage-based approach)
- ในระยะต้นของโรค (ระยะ IA–IIA)
และแม้กระทั่งในผู้ป่วยที่มีโรคจำกัดในระยะก้อนเนื้องอกบางราย (ระยะ IIB)
ควรเน้นการรักษาเฉพาะที่ผิวหนัง (skin-directed therapies)
(ดูเพิ่มเติมใน ตารางที่ 4)
ตัวอย่างการรักษาเฉพาะที่ผิวหนัง ได้แก่:
- ยาคอร์ติโคสเตียรอยด์ชนิดทาผิวหรือฉีดเฉพาะจุด (topical or intralesional corticosteroids)
- ยาทำลายเซลล์ชนิดทาเฉพาะที่ (topical cytotoxic agents) เช่น
- Mechlorethamine (nitrogen mustard)
- การฉายแสงรักษา (phototherapy) เช่น narrowband UVB หรือ PUVA
- การฉายรังสีเฉพาะที่ (localized radiotherapy)
ข้อพิจารณาพิเศษ:
- ในผู้ป่วยที่อยู่ใน ระยะ IA
อาจพิจารณาใช้วิธี เฝ้าระวังอย่างกระตือรือร้น (expectant management with active surveillance)
โดยยังไม่เริ่มการรักษาทันที
เหตุผลที่การรักษาเฉพาะที่ได้ผลดีใน MF:
- เพราะเซลล์มะเร็งใน MF มีลักษณะ skin-homing T cells
ซึ่ง มีแนวโน้มสะสมตัวอยู่ที่ชั้นหนังกำพร้าและหนังแท้ตื้น (epidermis และ superficial dermis)
ทำให้การรักษาเฉพาะที่มีประสิทธิภาพสูง
การใช้เคมีบำบัดชนิดหลายยาร่วมกัน (Systemic multi-agent chemotherapy):
- ไม่เหมาะสม สำหรับระยะเริ่มต้นของ MF
- เพราะ:
- ไม่ช่วยเพิ่มอัตราการรอดชีวิต
- และมีความเสี่ยงต่อ ผลข้างเคียงรุนแรง (considerable morbidity)
ตารางที่ 4
การรักษา Mycosis Fungoides (MF)
|
ระยะของโรค |
แนวทางการรักษา |
|
ระยะก่อนเกิดโรคเต็มตัว (Premycotic phase) |
- ทายา/ฉีดยา corticosteroids เฉพาะที่ |
|
ระยะ IA–IIA (ปื้น/คราบหนา) |
- PUVA* หรือ ยาทา HN2 |
|
ระยะ IIB (มีก้อนเนื้อที่ผิวหนัง) |
- PUVA หรือ HN2 ร่วมกับฉายรังสีเฉพาะที่ (หากมีก้อนจำนวนน้อย) |
|
ระยะ III (ผื่นแดงทั่วตัว, erythroderma) |
- การทำ ECP (extracorporeal photopheresis) |
|
ระยะ IV (มีการแพร่กระจายสู่ต่อมน้ำเหลืองหรืออวัยวะภายใน) |
- Brentuximab vedotin |
หมายเหตุเพิ่มเติม:
- BCNU (carmustine):
ยาทา bis-chloronitrosourea ใช้น้อยลงมากในปัจจุบัน - Anti-PD-1 antibodies:
ใช้รักษา Sézary syndrome ในผู้ป่วยที่มีการแสดงออกของ PD-1 - ยาปฏิชีวนะต้านเชื้อ Staphylococcus aureus:
อาจช่วยให้โรคดีขึ้นในบางราย - Dupilumab:
รายงานว่าการใช้ dupilumab อาจทำให้อาการของโรคแย่ลง - ตัวย่อที่สำคัญ:
- CHOP = Cyclophosphamide + Hydroxydaunomycin (Doxorubicin) + Oncovin® (Vincristine) + Prednisone
- ECP = Extracorporeal Photopheresis
- HDACi = Histone Deacetylase Inhibitors
- HN2 = ยา mechlorethamine แบบทา (nitrogen mustard)
- IFN = Interferon
- TSEB = Total Skin Electron Beam (การฉายรังสีอิเล็กตรอนทั่วตัว)
สัญลักษณ์เพิ่มเติม:
- = ควรจัดท่าผู้ป่วยเพื่อให้แน่ใจว่าพื้นที่ที่ถูกเสื้อผ้าปิด (เช่น ด้านในต้นขาด้านบน) ได้รับแสง UV อย่างเหมาะสม
- † = Retinoids เฉพาะที่ ได้แก่ Bexarotene 1% gel (ได้รับการรับรองจาก FDA สำหรับ CTCL), Tazarotene 0.1% gel, Alitretinoin 0.1% gel
- ‡ = ประสิทธิภาพของยาเหล่านี้เมื่อเทียบกับการรักษาแบบดั้งเดิม ยังต้องการการศึกษายืนยันเพิ่มเติม
- ¶ = Mogamulizumab มีประสิทธิภาพมากในผู้ป่วยที่มีการแพร่กระจายของโรคในกระแสเลือด (B2)
- § = หลีกเลี่ยงการใช้ mogamulizumab หากมีแผนจะปลูกถ่ายสเต็มเซลล์แบบ allogeneic เพราะอาจทำให้เกิด graft versus host disease รุนแรงขึ้น
การรักษาในผู้ป่วยที่ดื้อยา (Refractory) หรือโรคกำเริบ (Progressive)
- ในผู้ป่วยที่โรคที่ผิวหนัง ไม่ตอบสนองต่อการรักษา หรือ ดำเนินโรคต่อเนื่อง
การรักษาเฉพาะที่ผิวหนัง (skin-directed therapies) สามารถ - ใช้ร่วมกับ อินเตอร์เฟอรอนอัลฟา (IFN-α)
- หรือ ยาเรตินอยด์ชนิดรับประทาน (systemic retinoids) ได้
- อีกทางเลือกหนึ่ง: สามารถใช้ ยากลุ่มใหม่ เช่น
- Denileukin diftitox
- Mogamulizumab
- หรือ Histone deacetylase inhibitors (HDACi) เช่น
- Vorinostat
- Romidepsin
ก่อนที่จะพิจารณาใช้ เคมีบำบัดระบบ (systemic chemotherapy) - HDACi และ Denileukin diftitox
ได้รับการอนุมัติจาก FDA สำหรับผู้ป่วย CTCL ที่มีอาการ กำเริบหรือดื้อยา
แต่ยัง ไม่ได้รับการขึ้นทะเบียน สำหรับการใช้ในยุโรป - หมายเหตุ:
- Denileukin diftitox ถูกถอนออกจากตลาดในปี 2014
แต่มีการพัฒนาสูตรใหม่และอยู่ระหว่างการศึกษาเพิ่มเติม - โดยทั่วไป
การให้ เคมีบำบัดแบบระบบ ควรใช้เฉพาะใน ระยะโรคที่ลุกลามขั้นสูง
เช่น มีการแพร่กระจายไปยัง: - ต่อมน้ำเหลือง (nodal involvement)
- อวัยวะภายใน (visceral involvement)
หรือในผู้ป่วยที่มี ก้อนเนื้อที่โตอย่างรวดเร็ว และ ไม่ตอบสนองต่อการรักษาแบบเบากว่า
การรักษาเฉพาะที่ผิวหนัง (Skin-directed therapies)
ยาคอร์ติโคสเตียรอยด์ทาเฉพาะที่ (Topical corticosteroids)
- ในผู้ป่วย MF ที่มีแค่:
- ปื้น (patches) และ
- คราบบางๆ (thin plaques)
การทาคอร์ติโคสเตียรอยด์สามารถควบคุมโรคได้ดี - ในผู้ป่วย ระยะ patch/plaque จำกัด (โดยเฉพาะมีแค่ปื้น):
- รายงานการได้ การหายขาด (complete remission) สูงถึง 60% ของผู้ป่วย
- แม้ในระยะที่ลุกลามมากขึ้น:
- การทาคอร์ติโคสเตียรอยด์ยังคงมีบทบาทสำคัญเป็น การรักษาเสริม (adjuvant therapy)
เคมีบำบัดเฉพาะที่ (Topical chemotherapy)
- การทา Mechlorethamine (HN2) ที่ผิวหนัง
- ได้พิสูจน์แล้วว่ามีประสิทธิภาพสำหรับ MF ระยะเริ่มต้น
- รูปแบบยา:
- ผสมน้ำ (dissolved in water)
- หรือทำเป็นขี้ผึ้งหรือเจล (ointment- หรือ gel-based preparation)
(ดูรายละเอียดในบทที่ 129) - ผลการรักษา:
- ได้ การหายขาด (complete remission) ประมาณ 60%–80% ในผู้ป่วยระยะ IA–B
- ผลข้างเคียง:
- การระคายเคืองผิวหนัง
- การเกิด ผื่นแพ้สัมผัส (allergic contact dermatitis)
- ความเสี่ยงเพิ่มขึ้นต่อการเกิด มะเร็งผิวหนัง หากใช้ระยะยาว
การฉายรังสี (Radiotherapy)
การฉายรังสีอิเล็กตรอนทั่วตัว (Total Skin Electron Beam Irradiation - TSEB)
- ใช้พลังงาน 4–6 MeV
- เป็นการรักษาที่ มีประสิทธิภาพสูง ในผู้ป่วยที่มี MF จำกัดเฉพาะที่ผิวหนัง
- ขนาดรังสีมาตรฐาน:
- รวม 36 Gy
- แบ่งเป็นหลายครั้งๆ ละ 1.5–2 Gy
- ใช้เวลาฉายทั้งหมดประมาณ 8–10 สัปดาห์
- แนวโน้มปัจจุบัน:
- มีการใช้ ขนาดรังสีต่ำลง (10–12 Gy)
- ข้อดีคือ:
- ระยะเวลารักษาสั้นลง
- ผลข้างเคียงน้อยลง
- สามารถทำการรักษาซ้ำได้
- ประสิทธิภาพ:
- ในผู้ป่วยระยะ IA–B มีอัตราการหายขาด >80%
- ในผู้ป่วยระยะก้อนเนื้องอก (tumor stage MF) อัตราการหายขาดประมาณ ~40%
- ผลข้างเคียง:
โดยทั่วไป ไม่รุนแรง ได้แก่: - ผิวหนังแดง (erythema)
- ผิวหนังลอกขุย (scaling)
- ผม รากเล็บ ต่อมเหงื่อ หยุดทำงานชั่วคราว
การฉายรังสีเฉพาะที่ (Local radiotherapy)
- ใช้ X-ray หรือ ลำแสงอิเล็กตรอน (electron beam)
- เหมาะกับ:
- รักษาก้อนเดี่ยวในผู้ป่วยระยะ plaque
- หรือใช้เป็นทางเลือกหลังจากการทำ TSEB
- ขนาดรังสีที่เพียงพอ: ≥8 Gy
- ในผู้ป่วย MF ชนิด unilesional (มีรอยโรคแค่แห่งเดียว):
- การฉายรังสีเฉพาะที่ อาจทำให้หายขาดได้
การบำบัดด้วยแสง (Phototherapy)
- ประเภทที่ใช้ใน MF ได้แก่:
- PUVA therapy (Psoralen + UVA)
- Narrowband UVB therapy (แสง UVB ช่วง 311 nm)
- PUVA therapy:
- ถือเป็นมาตรฐานสำหรับการรักษา MF ระยะต้น
- ในระยะ IA–IIA:
- มีอัตราการหายขาด 80%–90%
- หลายศูนย์มีการทำ Maintenance PUVA (ฉายแสงทุก 2–4 สัปดาห์) เพื่อยืดเวลาการหาย
- ข้อสังเกต:
- แม้จะมีรายงานการหายขาดระยะยาว
- แต่ผู้ป่วยส่วนใหญ่ จะกลับมาเป็นซ้ำ หลังหยุดการรักษา หรือแม้แต่ระหว่างการทำ Maintenance
- จุดที่รอยโรคกลับเป็นซ้ำบ่อย:
- บริเวณที่ได้รับแสง UV น้อย เช่น
- ด้านในต้นขา
- ร่องก้น
- ในระยะก้อนเนื้องอก (tumor stage MF):
- PUVA อย่างเดียวไม่ค่อยให้ผลหายขาด
- แต่สามารถได้ผลดีขึ้นหาก ใช้ร่วมกับเรตินอยด์ระบบ (systemic retinoids), IFN-α, หรือ รังสีรักษา
- Narrowband UVB therapy (311 nm):
- เป็น การรักษาแนวหน้า (first-line therapy) สำหรับผู้ป่วยที่มีแค่ ปื้นผิวหนัง (patches)
การรักษาด้วยยาระบบ (Systemic Therapies) นอกเหนือจากเคมีบำบัด
อินเตอร์เฟอรอน (Interferons)
- ยากระตุ้นการตอบสนองทางชีวภาพที่ใช้กันบ่อยที่สุด คือ อินเตอร์เฟอรอนอัลฟา (IFN-α)
- ปกติให้ โดยการฉีดใต้ผิวหนัง ขนาด 3–9 ล้านหน่วย 3 ครั้งต่อสัปดาห์
- ผลข้างเคียง:
- อาการคล้ายไข้หวัดใหญ่
- ผมร่วง
- คลื่นไส้
- ภาวะซึมเศร้า
- และการกดไขกระดูก
ซึ่งส่วนใหญ่ มีความรุนแรงน้อยและกลับคืนได้ แต่ มักต้องมีการปรับลดขนาดยา - อัตราการตอบสนองโดยรวม ของ IFN-α เมื่อใช้เดี่ยว:
- ประมาณ 50%
- โดย 17% เป็นการหายขาด (complete remission)
- การใช้ร่วมกันของ PUVA และ IFN-α:
- ให้ผลการตอบสนองดีกว่าการใช้ PUVA อย่างเดียว
- จึงอาจใช้ในผู้ป่วย ระยะต้นที่มีก้อนเนื้องอก ซึ่งการรักษาด้วย PUVA อย่างเดียวไม่พอ
เรตินอยด์ (Retinoids)
- เรตินอยด์ชนิดรับประทานหลายชนิด ได้แก่:
- Isotretinoin
- Acitretin
- และเรตินอยด์ชนิดใหม่ที่เลือกจับกับ RXR (Bexarotene)
- ผลตอบสนองโดยรวมและอัตราการหายขาด
ของเรตินอยด์เหล่านี้ ใกล้เคียงกับ IFN-α - RePUVA:
(การใช้ retinoids + PUVA) - ให้ผลตอบสนองใกล้เคียงกับ PUVA เพียงอย่างเดียว
- แต่ผู้ป่วยที่ได้รับ RePUVA ต้องฉายแสงน้อยครั้งกว่า และได้รับปริมาณ UVA สะสมน้อยกว่า
- ปัจจุบันหลายศูนย์ใช้ bexarotene แทนเรตินอยด์รุ่นเก่า
(แต่ยังไม่มีการเปรียบเทียบในการศึกษาทางคลินิกโดยตรง) - กรณีเป็นแค่ปื้นหรือคราบบาง:
- อาจใช้ เรตินอยด์เฉพาะที่ เช่น
- Bexarotene 1% gel (ได้รับการรับรองโดย FDA สำหรับ CTCL)
- Tazarotene 0.1% gel
- Alitretinoin 0.1% gel
- แต่ การระคายเคืองผิวหนัง เป็นข้อจำกัดสำคัญ
Denileukin Diftitox
- เป็นโปรตีนหลอมรวม (fusion protein)
ซึ่งเชื่อม diphtheria toxin กับ IL-2 - มันจับกับ ตัวรับ IL-2 บนเซลล์ T มะเร็งใน MF
และเมื่อสารพิษถูกดูดซึมเข้าสู่เซลล์
จะทำให้การสังเคราะห์โปรตีนถูกยับยั้งและเซลล์ตาย - อัตราการตอบสนองโดยรวม: ~30%
- อัตราการหายขาด: ~10%
- ผลข้างเคียงสำคัญ:
- Capillary leak syndrome (ภาวะน้ำรั่วจากหลอดเลือดฝอย)
- ไข้
- บวมน้ำ
- สถานะปัจจุบัน:
- Denileukin diftitox ถูกถอนออกจากตลาดในปี 2014
- มีการพัฒนาสูตรใหม่และอยู่ระหว่างการศึกษา
ยากลุ่ม Histone Deacetylase Inhibitors (HDACi)
- เช่น:
- Vorinostat
- Romidepsin
- ยากลุ่มนี้ยับยั้งเอนไซม์ HDAC
ส่งผลต่อการแสดงออกของยีนที่เกี่ยวข้องกับ: - การแบ่งตัว
- การเปลี่ยนแปลง
- การเคลื่อนที่
- และการตายของเซลล์
- อัตราการตอบสนองโดยรวม: ~35% ในผู้ป่วย MF และ SS
(แต่การหายขาดจริงพบได้น้อย) - ผลข้างเคียงที่พบบ่อย:
- อ่อนเพลีย (fatigue)
- อาการทางระบบทางเดินอาหาร
- เกล็ดเลือดต่ำแบบกลับคืนได้ (reversible thrombocytopenia)
- หมายเหตุ:
ยังไม่สามารถระบุได้แน่ชัดว่า ผู้ป่วยกลุ่มใด ที่เหมาะสมที่สุดกับการรักษานี้
Mogamulizumab
โมโนโคลนอลแอนติบอดี mogamulizumab
เป็นแอนติบอดีที่มีเป้าหมายที่ ตัวรับเคมีโมไคน์ CCR4 (CC chemokine receptor 4)
ซึ่งเป็นตัวรับที่พบได้อย่างสม่ำเสมอบนเซลล์ T มะเร็งในโรค Mycosis Fungoides (MF) และ Sézary Syndrome (SS)
รวมถึงพบได้บน:
- T helper ชนิด Th2
- Th17
- และ regulatory T cells
การออกฤทธิ์ของ mogamulizumab:
- นำไปสู่การ ทำลายเซลล์เป้าหมาย ผ่านกลไก antibody-dependent cellular cytotoxicity (ADCC)
ประสิทธิภาพทางคลินิก:
- Mogamulizumab แสดงให้เห็นถึง ประสิทธิภาพในการรักษาที่สำคัญ ทั้งใน MF และ SS
- แต่ มีประสิทธิภาพดีที่สุดในผู้ป่วยที่มีการแพร่กระจายในเลือด (blood involvement)【39】
ผลข้างเคียงเฉพาะที่พบ: Mogamulizumab-associated rash (MAR)
- ผู้ป่วยบางรายอาจเกิด ผื่นที่เกี่ยวข้องกับ mogamulizumab (MAR)
- มักเกิดบริเวณ ใบหน้าและลำคอ
- และอาจ มีลักษณะคล้ายกับ MF ทำให้วินิจฉัยแยกได้ยาก【39a】
ลักษณะทางคลินิกของ MAR มีได้หลายรูปแบบ เช่น:
- ผื่นคล้าย folliculotropic MF ที่หนังศีรษะ ร่วมกับ ผมร่วง
- ผื่นแบบกระจายตามแนวที่โดนแสง (photodistributed dermatitis)
- ผื่นแบบ morbilliform (คล้ายหัด)
- และ erythroderma (ผื่นแดงทั่วตัว)
ลักษณะทางพยาธิวิทยา (Histology):
- อาจพบลักษณะ:
- Psoriasiform (คล้ายสะเก็ดเงิน)
- Spongiotic (มีภาวะน้ำคั่งระหว่างเซลล์)
- Lichenoid
- และ/หรือ Granulomatous
การแยกความแตกต่าง MAR กับการกลับเป็นซ้ำของ MF/SS:
ตัวช่วยในการวินิจฉัยแยกโรค ได้แก่:
- การตรวจพบว่า สัดส่วน CD4:CD8 ภายในหนังกำพร้ามีค่ากลับด้านหรือกลับสู่ปกติ
- ไม่พบเซลล์ T มะเร็งแบบ clonal
แนวทางการรักษาผื่น MAR:
- ทายา corticosteroids ความแรงสูง
- หรือใช้ corticosteroids ชนิดระบบ (กินหรือฉีด)
- หรือ methotrexate
- อาจพิจารณาเว้นช่วงการให้ยา mogamulizumab หรือ หยุดยา หากจำเป็น
เคมีบำบัดระบบ (Systemic Chemotherapy)
- ในผู้ป่วยที่:
- โรคลุกลามมาก
- และดื้อต่อการรักษาอื่นๆ
- อาจพิจารณาใช้:
- Gemcitabine
- หรือ Liposomal doxorubicin
(แต่ผลตอบสนองมักอยู่ได้ไม่นาน) - Brentuximab vedotin:
- เป็นแอนติบอดีต่อต้าน CD30 (anti-CD30 monoclonal antibody)
- เชื่อมกับยา monomethyl auristatin E (ทำลายเส้นใยไมโครทูบูลิน)
- ใช้ได้ผลดีใน MF/SS ระยะลุกลามที่มีการแสดงออกของ CD30
- เคมีบำบัดหลายชนิดร่วมกัน (Multi-agent chemotherapy):
- ใช้เฉพาะในผู้ป่วยที่มี:
- การแพร่กระจายต่อมน้ำเหลืองหรืออวัยวะภายในอย่างชัดเจน
- หรือเนื้องอกผิวหนังที่ไม่ตอบสนองต่อการรักษาอื่น
- มาตรฐานเดิมคือ:
- การให้ 6 รอบของสูตร CHOP (Cyclophosphamide + Doxorubicin + Vincristine + Prednisone)
- หมายเหตุ:
- แม้จะให้ผลตอบสนองสูงต่อโรคนอกผิวหนัง
- แต่การตอบสนองมักอยู่ได้ ไม่นาน
- และรอยโรคที่ผิวหนัง (patches/plaques) มัก ตอบสนองน้อยกว่า ต้องรักษาเสริมด้วย PUVA หรือ mechlorethamine
การปลูกถ่ายสเต็มเซลล์ (Stem Cell Transplantation)
- ในผู้ป่วย อายุน้อย ที่มี MF และ SS แบบ ดื้อยาและลุกลาม
อาจพิจารณา: - การปลูกถ่ายสเต็มเซลล์จากผู้บริจาค (allogeneic HSCT)
- การใช้สูตรการกดภูมิคุ้มกันแบบลดความเข้มข้น (reduced-intensity conditioning)
มีรายงานว่าให้ผลตอบสนองที่ยาวนาน - อย่างไรก็ตาม:
- สูตรการกดภูมิคุ้มกันที่เหมาะสมที่สุด
- และ เวลาที่เหมาะสมที่สุดสำหรับการปลูกถ่าย
ยังอยู่ระหว่างการถกเถียง【27】 - ก่อนการปลูกถ่าย อาจทำการลดปริมาณเนื้องอกด้วย:
- TSEB หรือ
- Brentuximab vedotin
- ผลการปลูกถ่ายแบบอัตโนมัติ (autologous HSCT):
- ผลลัพธ์ไม่ดีนักใน MF/SS
- บ่งชี้ว่า การตอบสนองแบบ graft-versus-tumor มีความจำเป็น
พยากรณ์โรค (Prognosis)
พยากรณ์โรคของผู้ป่วย Mycosis Fungoides (MF)
ขึ้นอยู่กับ:
- ระยะของโรค (Stage)
- โดยเฉพาะอย่างยิ่ง:
- ชนิดและขอบเขตของรอยโรคผิวหนัง
- และ การมีอยู่หรือไม่ของการลุกลามนอกผิวหนัง (extracutaneous disease)
รายละเอียดพยากรณ์โรค:
- ผู้ป่วยที่มี MF ระยะ patch/plaque แบบจำกัดพื้นที่
มีอัตราการรอดชีวิตระยะยาว ใกล้เคียงกับประชากรทั่วไป
ที่จับคู่ตามอายุ เพศ และเชื้อชาติ - อัตราการรอดชีวิตที่เกี่ยวข้องกับโรคในระยะ 10 ปี:
- Stage IA: 96%
- Stage IB: 77%–83%
- Stage IIB: 42%
- Stage IV: 20%
สาเหตุการเสียชีวิตหลักของผู้ป่วย MF:
- การลุกลามของโรคสู่ระบบภายใน (systemic involvement)
- หรือการติดเชื้อ (infections)
สรุปสั้น ๆ:
- ยิ่งระยะโรคมากขึ้น → พยากรณ์โรคยิ่งแย่ลง
- การรักษาตั้งแต่ระยะเริ่มต้นและการควบคุมโรคที่ผิวหนังมีบทบาทสำคัญต่อการยืดชีวิต
CATEGORY

MEMBER
- ระดับ{{userdata.dropship_level_name}}
- ไปหน้าหลักตัวแทน
- ทั้งหมด {{(order_nums && order_nums.all)?'('+order_nums.all+')':''}}
- รอการชำระเงิน {{(order_nums && order_nums.wait_payment)?'('+order_nums.wait_payment+')':''}}
- รอตรวจสอบยอดเงิน {{(order_nums && order_nums.wait_payment_verify)?'('+order_nums.wait_payment_verify+')':''}}
- รอจัดส่งสินค้า {{(order_nums && order_nums.wait_send)?'('+order_nums.wait_send+')':''}}
- รอยืนยันได้รับสินค้า {{(order_nums && (order_nums.wait_receive || order_nums.wait_confirm))?'('+(order_nums.wait_receive+order_nums.wait_confirm)+')':''}}
- รอตรวจสอบข้อร้องเรียน {{(order_nums && order_nums.dispute)?'('+order_nums.dispute+')':''}}
- เรียบร้อยแล้ว {{(order_nums && order_nums.completed)?'('+order_nums.completed+')':''}}
- ทั้งหมด {{(order_nums && order_nums.all)?'('+order_nums.all+')':''}}
- รอการชำระเงิน {{(order_nums && order_nums.wait_payment)?'('+order_nums.wait_payment+')':''}}
- รอตรวจสอบยอดเงิน{{(order_nums && order_nums.wait_payment_verify)?'('+order_nums.wait_payment_verify+')':''}}
- รอจัดส่งสินค้า {{(order_nums && order_nums.wait_send)?'('+order_nums.wait_send+')':''}}
- ส่งสินค้าเรียบร้อยแล้ว {{(order_nums && order_nums.sent)?'('+order_nums.sent+')':''}}
STATISTICS
| หน้าที่เข้าชม | 390,966 ครั้ง |
| ผู้ชมทั้งหมด | 190,096 ครั้ง |
| เปิดร้าน | 15 มี.ค. 2560 |
| ร้านค้าอัพเดท | 20 พ.ย. 2568 |
TRACK&TRACE
CONTACT US
Line Official


อีเมล : sutatclinic@gmail.com
TOP เลื่อนขึ้นบนสุด



